题目内容
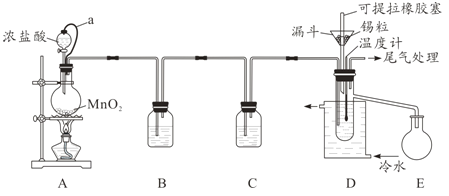
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
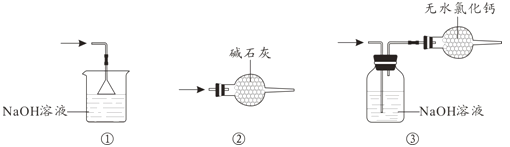
(4)尾气处理时,可选用的装置是__________(填序号)。
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
【答案】平衡压强使浓盐酸顺利流下 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 避免SnCl4挥发 ② 常温下,CuCl2为固体且密度比SnCl4大 85%
Mn2++Cl2↑+2H2O 避免SnCl4挥发 ② 常温下,CuCl2为固体且密度比SnCl4大 85%
【解析】
根据装置:A装置制备氯气:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,其中a可以平衡压强,使浓盐酸顺利流下,B吸收杂质HCl气体,C吸收水蒸气,干燥纯净的Cl2与Sn在D中反应制得SnCl4,锡粒中含铜杂质使得D中产生的SnCl4中含有CuCl2,但因为CuCl2熔点高,为固体,且密度比SnCl4大,不会随SnCl4液体溢出,E收集SnCl4液体,尾气用盛放碱石灰的干燥管处理,据此分析作答。
Mn2++Cl2↑+2H2O,其中a可以平衡压强,使浓盐酸顺利流下,B吸收杂质HCl气体,C吸收水蒸气,干燥纯净的Cl2与Sn在D中反应制得SnCl4,锡粒中含铜杂质使得D中产生的SnCl4中含有CuCl2,但因为CuCl2熔点高,为固体,且密度比SnCl4大,不会随SnCl4液体溢出,E收集SnCl4液体,尾气用盛放碱石灰的干燥管处理,据此分析作答。
(1)a管的作用是平衡浓盐酸上下的气体压强,使浓盐酸顺利流下;
(2)A中浓盐酸与MnO2混合加热制取Cl2,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)在D中制取的物质SnCl4中含有杂质CuCl2,SnCl4易挥发,所以D中冷却水的作用是避免SnCl4挥发;
(4)尾气中含有氯气会导致大气污染,因此一定要进行处理,可根据Cl2与碱反应的性质,用碱性物质吸收,同时为防止SnCl4水解,该装置还具有干燥的作用,用盛放碱石灰的干燥管可满足上述两个条件,故合理选项是②;
(5)锡粒中含铜杂质致D中产生CuCl2,但因为常温下,CuCl2为固体且密度比SnCl4大,故不影响E中产品的纯度;
(6)滴定中,铁元素化合价由+2价变为+3价,升高1价,Cr元素化合价由+6价变为+3价,降低3价,则有关系式:3SnCl2~6Fe2+~K2Cr2O7,n(SnCl2)=3n(K2Cr2O7) =3×0.1000mol/L×0.02L=0.006mol,故SnCl4产品的纯度为![]() ×100%=85%。
×100%=85%。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥