题目内容
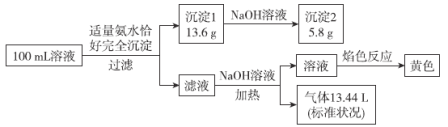
【题目】有一包白色粉末,由Na2SiO3、BaSO4、BaCO3、Na2SO3、NaOH中的一种或几种组成,为了探究它的成分,进行了如下实验:

下列判断错误的是( )
A.生成白色沉淀D的离子方程式为SiO32-+2H+=H2SiO3↓
B.BaSO4一定不存在,NaOH可能存在
C.Na2SiO3、BaSO4、BaCO3、Na2SO3一定存在,NaOH可能存在
D.气体B和气体E均可使澄清的石灰水变浑浊
【答案】C
【解析】
由探究实验流程可知,白色滤渣A与盐酸反应生成气体B,则A为CaCO3,B为CO2,无色溶液C与盐酸反应生成白色沉淀,则C中含Na2SiO3、Na2SO3,白色沉淀D为硅酸,气体E为SO2,由上分析可知,一定存在Na2SiO3、Na2SO3、CaCO3,不存在BaSO4,无法判断NaOH,以此来解答。
A. 生成白色沉淀D为硅酸,离子方程式为SiO32-+2H+=H2SiO3↓,A项正确;
B. 由分析可知,BaSO4一定不存在,NaOH可能存在,B项正确;
C. 由分析可知,BaSO4一定不存在,C项错误;
D. B为CO2,E为SO2,均可使澄清的石灰水变浑浊,D项正确;
答案选C。

【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥