题目内容
11.将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是( )| A. | 0.05mol/L | B. | 0.1mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
分析 Fe3O4中+2铁占$\frac{1}{3}$,完全溶解后溶液中含有Fe2+为0.15mol,加入K2Cr2O7溶液250mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化成Cr3+,令K2Cr2O7的物质的量浓度为cmol/L,表示出Cr2O72-物质的量,根据电子转移守恒列方程计算.
解答 解:Fe3O4中+2铁占$\frac{1}{3}$,完全溶解后溶液中含有Fe2+为0.15mol×3×$\frac{1}{3}$=0.15mol,加入K2Cr2O7溶液250mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化成Cr3+,令K2Cr2O7的物质的量浓度为cmol/L,则:
250×10-3L×cmol/L×2×(6-3)=0.15mol×1
解得:c=0.1
故选:B.
点评 本题考查氧化还原反应的计算,侧重于学生的分析、计算能力的考查,难度中等,涉及两步反应,利用方程式计算比较麻烦,关键抓住氧化还原反应中电子转移守恒计算.

练习册系列答案
相关题目
1.下列物质的包装上贴错了危险警告标签的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列变化中,需加入适当的还原剂才能完成的是( )
| A. | FeCl2→FeCl3 | B. | CuO→Cu | C. | KMnO4→MnO2 | D. | Cl2→NaCl |
19.某有机物的结构简式如图所示,下列有关物质的说法正确的是( )
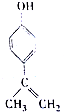

| A. | 该物质的分子式是C9H11O | |
| B. | 该物质分子中的所有C原子可以共面 | |
| C. | 滴入KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别是3mol、4mol |
6.某化合物的结构图1(键线式)及球棍模型如图2:

该有机分子的核磁共振氢谱图如图3(单位是ppm).下列关于该有机物的叙述,不正确的是( )

该有机分子的核磁共振氢谱图如图3(单位是ppm).下列关于该有机物的叙述,不正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1mol该有机物完全燃烧可以产生6mol水 |
16.下列关于溶液中离子的说法正确的是( )
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
20.下列除杂操作可行的是( )
| A. | 通过浓硫酸除去HCl中的H2O | |
| B. | 通过灼热的CuO除去H2中的CO | |
| C. | 通过灼热的镁粉除去CO2中的N2 | |
| D. | 通过饱和碳酸氢钠溶液除去Cl2中的HCl |
7.下列物质不能通过单质直接化合制备的是( )
| A. | Na2O | B. | FeCl2 | C. | Na2O2 | D. | CuCl2 |
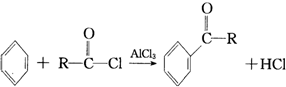
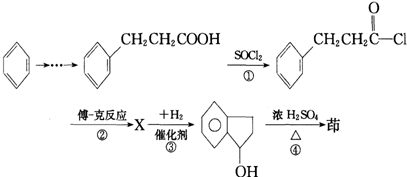
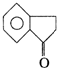
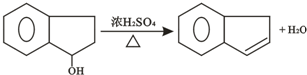
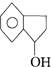 互为同分异构,满足下列三个条件:
互为同分异构,满足下列三个条件: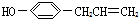
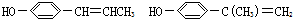 (其中两个).
(其中两个).