题目内容
9.下列离子方程式正确的是( )| A. | 向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O | |
| B. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
分析 A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀,二者物质的量之比为1:1,反应生成硫酸钡、一水合氨和水;
B.澄清石灰水中氢氧化钙应拆成离子形式;
C.钠与水反应生成氢氧化钠和氢气;
D.硫酸钡为沉淀,应保留化学式.
解答 解:A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀,二者物质的量之比为1:1,反应生成硫酸钡、一水合氨和水,离子方程式:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O,故A正确;
B.澄清石灰水与稀盐酸反应,离子方程式:OH-+H+=H2O,故B错误;
C.钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故C正确;
D.碳酸钡中加入稀硫酸,离子方程式:BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O,故D错误;
故选:AC.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式拆分、注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
10.X、Y、Z三者均为短周期元素,已知X元素有一种同位素不含中子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素原子的最外层电子数是次外层电子数的3倍.下列化学式①XYZ3②X2YZ2③X2YZ3④X2Y2Z2⑤X2Y2Z4⑥X4Y2Z2中,并非都存在的一组分子是( )
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
17. 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
请回答下列问题:
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
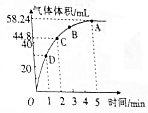
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
14. 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有dbeca(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环乙醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
1.下列说法正确的是( )
| A. | 分子中含有羟基的物质溶于水后,溶液一定显酸性 | |
| B. | 丙酸、乙酸甲酯、甲酸乙酯互为同分异构体 | |
| C. | 能发生银镜反应的一定是醛 | |
| D. | 乙醇发生酯化反应断裂碳氧键而失去羟基 |
19.化学与人类生产、生活、社会可持续发展密切相关.下列说法不正确的是( )
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 火力发电中,燃烧是使化学能转换为电能的关键 | |
| C. | 塑胶跑道的主要成分聚氨酯属于有机高分子化合物 | |
| D. | 原子经济性反应是绿色化学的重要内容 |
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.


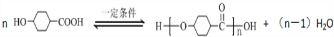 .
. .
. .
.