题目内容
Fe2O3高温下通CO气体,写出化学方程式: , 是氧化剂, 元素被还原, 是氧化产物,电子转移总数为 。
Fe2O3+3CO 2Fe+3CO2 ; Fe2O3;Fe;CO2; 12
2Fe+3CO2 ; Fe2O3;Fe;CO2; 12
 2Fe+3CO2 ; Fe2O3;Fe;CO2; 12
2Fe+3CO2 ; Fe2O3;Fe;CO2; 12

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题: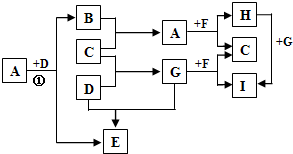


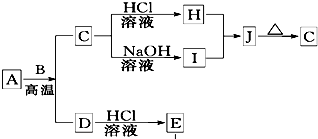 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3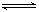 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式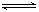 HSO3-+OH-
HSO3-+OH-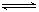 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是