题目内容
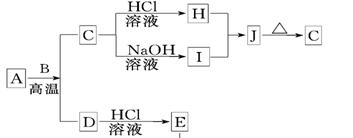
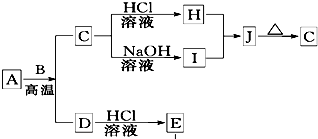 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
.(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
;
| ||
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
.(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1.则反应物中A、D、HCl的物质的量之比为
1:2:8
1:2:8
.分析:A是一种红棕色金属氧化物,则A为Fe2O3,由转化关系可知,B为Al,D为Fe,所以E是氯化亚铁溶液,D是金属单质铁,A和B的反应为铝热反应,C为Al2O3,又因为J是一种难溶于水的白色化合物并易受热分解,推知J为Al(OH)3,H是氯化铝,I是偏铝酸钠,然后结合物质的性质及化学用语来解答.
解答:解:A是一种红棕色金属氧化物,则A为Fe2O3,由转化关系可知,B为Al,D为Fe,所以E是氯化亚铁溶液,D是金属单质铁,A和B的反应为铝热反应,C为Al2O3,又因为J是一种难溶于水的白色化合物并易受热分解,推知J为Al(OH)3,H是氯化铝,I是偏铝酸钠,
(1)E的溶液中加入氢氧化钠溶液,反应生成氢氧化亚铁沉淀,然后被氧化,可以观察到的现象是先生成白色沉淀,迅速变为灰绿色,最终变为红褐色,
故答案为:先生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(2)①A与B在高温条件下生成C和D的化学方程式为Fe2O3+2Al
Al2O3+2Fe,故答案为:Fe2O3+2Al
Al2O3+2Fe;
②在E的水溶液中通入氯气后的生成物为氯化铁,和I溶液反应的离子方程式为Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓,
故答案为:Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓;
(3)溶液中滴加KSCN溶液不显红色,则溶液中只有亚铁离子,由Fe+2HCl=FeCl2+H2↑,Fe2O3+6HCl=2FeCl3+3H2O,Fe+2FeCl3=3FeCl2,生成的E与H2的物质的量之比为4:1,则Fe+2HCl=FeCl2+H2↑
1 2 1 1
Fe+2FeCl3=3FeCl2,
1 2 3
Fe2O3+6HCl=2FeCl3+3H2O
1 6 2
反应物中A、D、HCl的物质的量之比为1:2:8,故答案为:1:2:8.
(1)E的溶液中加入氢氧化钠溶液,反应生成氢氧化亚铁沉淀,然后被氧化,可以观察到的现象是先生成白色沉淀,迅速变为灰绿色,最终变为红褐色,
故答案为:先生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(2)①A与B在高温条件下生成C和D的化学方程式为Fe2O3+2Al
| ||
| ||
②在E的水溶液中通入氯气后的生成物为氯化铁,和I溶液反应的离子方程式为Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓,
故答案为:Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓;
(3)溶液中滴加KSCN溶液不显红色,则溶液中只有亚铁离子,由Fe+2HCl=FeCl2+H2↑,Fe2O3+6HCl=2FeCl3+3H2O,Fe+2FeCl3=3FeCl2,生成的E与H2的物质的量之比为4:1,则Fe+2HCl=FeCl2+H2↑
1 2 1 1
Fe+2FeCl3=3FeCl2,
1 2 3
Fe2O3+6HCl=2FeCl3+3H2O
1 6 2
反应物中A、D、HCl的物质的量之比为1:2:8,故答案为:1:2:8.
点评:本题考查无机物的推断,把握氧化铁及铝热反应为解答本题的突破口,侧重于金属及其化合物相互转化的考查,(3)中计算为解答的易错点,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目