题目内容
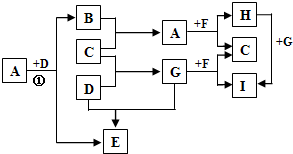
(2012?梧州模拟)有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示.其中B、C、D为单质,常温下D为固态,B、C、E、G为气态,F为淡黄色粉末,I的焰色反应为黄色.
请回答:
(1)写出F的电子式
 ,其化学键类型有
,其化学键类型有
(2)I的溶液呈
(3)反应①的产物通常作为城镇居民的燃气,也可用于冶金工业.请展示它们在冶金工业上的一个应用(用化学反应方程式表示)
(4)在标准状况下,若将11.2L气体G通入350mL 2mol/L的H溶液中,反应后溶液中离子浓度由大到小的顺序依次是

请回答:
(1)写出F的电子式


离子键和(非极性)共价键
离子键和(非极性)共价键
;(2)I的溶液呈
碱
碱
性(填酸性、中性或碱性),原因用离子反应方程式表示为:CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;(3)反应①的产物通常作为城镇居民的燃气,也可用于冶金工业.请展示它们在冶金工业上的一个应用(用化学反应方程式表示)
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(4)在标准状况下,若将11.2L气体G通入350mL 2mol/L的H溶液中,反应后溶液中离子浓度由大到小的顺序依次是
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.分析:F为淡黄色粉末,应为Na2O2,A和G都能与过氧化钠反应,则应为H2O和CO2的一种,C为O2,应G为气体,则G为CO2,A为H2O,H为NaOH,I为Na2CO3,B为H2,D为C,E为CO,结合对应物质的性质以及题目要求解答该题.
解答:解:F为淡黄色粉末,应为Na2O2,A和G都能与过氧化钠反应,则应为H2O和CO2的一种,C为O2,应G为气体,则G为CO2,A为H2O,H为NaOH,I为Na2CO3,B为H2,D为C,E为CO,
(1)F为Na2O2,电子式为 ,含有离子键和共价键,故答案为:
,含有离子键和共价键,故答案为: ;离子键和(非极性)共价键;
;离子键和(非极性)共价键;
(2)I为Na2CO3,为强碱弱酸盐,水解呈碱性,离子方程式为CO32-+H2O?HCO3-+OH-,故答案为:碱;CO32-+H2O?HCO3-+OH-;
(3)CO具有还原性,常用于热还原法冶炼金属,如还原铁,反应的化学方程式为3CO+Fe2O3
2Fe+3CO2,故答案为:3CO+Fe2O3
2Fe+3CO2;
(4)G为CO2,n(CO2)=0.5mol,H为NaOH,n(NaOH)=0.7mol,反应的离子方程式为5CO2+7OH-=2CO32-+3HCO3-+2H2O,溶液水解呈碱性,且CO32-水解程度大于HCO3-,溶液中离子浓度大小为,
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(1)F为Na2O2,电子式为
 ,含有离子键和共价键,故答案为:
,含有离子键和共价键,故答案为: ;离子键和(非极性)共价键;
;离子键和(非极性)共价键;(2)I为Na2CO3,为强碱弱酸盐,水解呈碱性,离子方程式为CO32-+H2O?HCO3-+OH-,故答案为:碱;CO32-+H2O?HCO3-+OH-;
(3)CO具有还原性,常用于热还原法冶炼金属,如还原铁,反应的化学方程式为3CO+Fe2O3
| ||
| ||
(4)G为CO2,n(CO2)=0.5mol,H为NaOH,n(NaOH)=0.7mol,反应的离子方程式为5CO2+7OH-=2CO32-+3HCO3-+2H2O,溶液水解呈碱性,且CO32-水解程度大于HCO3-,溶液中离子浓度大小为,
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意根据物质的颜色等性质作为解答该题的突破口,难度不大,注意离子浓度的大小比较.

练习册系列答案
相关题目
 (2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( )
(2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( ) (2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )
(2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )