题目内容
4.两份质量不同的铝屑,第一份与过量的盐酸反应,第二份与过量的氢氧化钠溶液反应,相同条件下产生氢气的体积比为1:3,则第一份与第二份铝屑的质量比为( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
分析 铝与盐酸、NaOH溶液反应的化学方程式分别为2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,盐酸以及NaOH溶液足量,则铝完全反应,结合反应及m=nM计算.
解答 解:盐酸与NaOH溶液均足量,则铝完全反应,
相同条件下产生氢气的体积比为1:3,体积比等于物质的量比,
设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为3mol、9mol,
由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,消耗的Al分别为2mol、6mol,
两个反应中消耗的Al的物质的量比等于质量比,
则第一份与第二份铝屑的质量比为2:6=1:3,
故选C.
点评 本题考查化学反应的有关计算,为高频考点,把握发生的反应、反应中物质的量关系、质量与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意酸、碱足量,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列金属通常采用热还原法冶炼的是( )
| A. | 银 | B. | 铝 | C. | 钠 | D. | 铁 |
12.下列模型表示四种分子,分子中所有原子处于同一平面的是( )
| A. |  | B. |  | C. |  | D. |  |
19.化学与社会、科学、技术、环境和生活有密切关系.下列说法不正确的是( )
| A. | 含氮、磷的污水任意排放会污染水体,导致水华、赤潮等 | |
| B. | 油脂能增加食物的滋味,增进食欲,保证机体的正常生理功能 | |
| C. | 利用高纯单质硅的半导体性能,可以制成光电池 | |
| D. | 纤维素和淀粉是同分异构体,在人体内均可水解成葡萄糖为人体提供能量 |
9.下列化学用语书写正确的是( )
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 乙烯的结构简式:C2H4 | |
| C. | 四氯化碳的电子式为: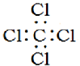 | |
| D. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co |
16.生活中常常碰到涉及化学知识的某些问题,下列叙述正确的是( )
①人的皮肤在强紫外线的照射下将会失去生理活性;
②用苯酚对食物进行消毒是国家允许的;
③米酒变酸的过程发生了氧化反应;
④棉花和人造丝的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质;
⑤蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,可在患处涂抹小苏打或稀氨水.
①人的皮肤在强紫外线的照射下将会失去生理活性;
②用苯酚对食物进行消毒是国家允许的;
③米酒变酸的过程发生了氧化反应;
④棉花和人造丝的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质;
⑤蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,可在患处涂抹小苏打或稀氨水.
| A. | ①③④⑤ | B. | ③④⑤ | C. | ①②④ | D. | 全部 |
13.可逆反应在一定条件下达到化学平衡时,下列说法错误的是( )
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH