题目内容
18.某温度(t℃)时,水的Kw=1×10-12,该温度下,c(H+)=1×10-7 mol•L-1的溶液呈碱(填“酸性”、“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=10-7mol•L-1.分析 由c(H+)、c(OH-)的相对大小判断溶液的酸碱性,由H2O电离出来的c(OH-)=由H2O电离出来的c(H+),以此来解答.
解答 解:水的Kw=1×10-12,该温度下,c(H+)=1×10-7mol•L-1的溶液,c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=1×10-5mol•L-1,氢氧根离子浓度大于氢离子浓度,溶液为碱性,该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=H2O电离出来的c(H+)=10-7mol•L-1.
故答案为:碱;10-7.
点评 本题考查溶液酸碱性判断,为高频考点,把握c(H+)、c(OH-)的关系为解答的关键,侧重分析与应用能力的考查,注意水的电离及Kw的应用,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
9.实验室里需要480mL 0.100mol/L的CuSO4溶液,以下操作正确的是( )
| A. | 称取7.68gCuSO4,加入500mL水 | |
| B. | 称取12.5g胆矾,配成480mL溶液 | |
| C. | 称取8.0gCuSO4,加入到500mL水中配成溶液 | |
| D. | 称取12.5g胆矾,配成500mL溶液 |
6.氢化亚铜(CuH)是一种难溶物,能在Cl2中燃烧生成CuCl2和HCl,与盐酸反应生成CuCl和H2.下列关于氢化亚铜的推断正确的是( )
| A. | CuH与盐酸的反应属于置换反应 | |
| B. | CuH在Cl2中燃烧,1molCuH转移电子数为2NA | |
| C. | CuH在Cl2中燃烧时铜元素和氢元素均被氧化 | |
| D. | CuH与盐酸反应的离子方程式:H-+H+═H2↑ |
3.a g H2SO4中含有b个氢原子,则阿伏加德罗常数为( )
| A. | $\frac{49a}{b}$ mol-1 | B. | $\frac{49b}{a}$ mol-1 | C. | $\frac{98a}{b}$ mol-1 | D. | $\frac{98b}{a}$ mol-1 |
10.2015年 10月,中国科学家屠呦呦获得了诺贝尔生理学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.青蒿素的分子式为 C15H22O5,则关于青蒿素的说法中正确的是( )
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的摩尔质量为 282 | |
| C. | 56.4g青蒿素中所含氧原子数目为 6.02×1023个 | |
| D. | 青蒿素中 C、H、O元素的质量比为 15:22:5 |
7.反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
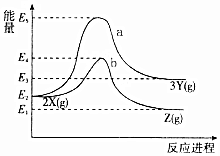

| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
12.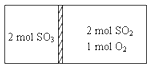 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )| A. | 恒温条件下,达到平衡容器两边SO3的体积分数相同 | |
| B. | 恒温条件下,容器中两边的吸收或放出的热量数值之和小于为196kJ | |
| C. | 若容器为绝热,达到平衡时右室反应速率等于左室反应速率 | |
| D. | 若容器为绝热容器,右室中SO2的转化率与左室SO3的转化率之和小于1 |
 的烃,该分子中最多有6个碳原子处于同一直线上,至少有10碳原子处于同一平面上.
的烃,该分子中最多有6个碳原子处于同一直线上,至少有10碳原子处于同一平面上.