题目内容
有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍.则混合气体中CH4、C2H6、C3H8的体积比不可能是( )
| A、2:1:2 |
| B、2:3:1 |
| C、1:4:1 |
| D、5:3:5 |
考点:有关混合物反应的计算
专题:计算题
分析:CH4、C2H6、C3H8组成的混合气,是同温同压下H2密度的15倍,则混合气体的平均摩尔质量为:2g/mol×15=30g/mol,而C2H6的相对分子质量也为30,则满足CH4、C3H8的平均相对分子质量为30即可,与乙烷的含量无关;根据十字交叉法计算CH4、C3H8的体积比,以此解答判断.
解答:
解:CH4、C2H6、C3H8组成的混合气,是同温同压下H2密度的15倍,根据M=ρVm可知,摩尔质量与密度成正比,混合气体的平均摩尔质量为:2g/mol×15=30g/mol,由于C2H6的相对分子质量为30,则CH4与C3H8的平均相对分子质量必须为30,即满足CH4、C3H8的平均相对分子质量为30即可,与乙烷的含量无关,
根据十字交叉法计算CH4、C3H8的体积比,

CH4和C3H8的体积之比为14:14=1:1,C2H6的体积为任意体积,所以ACD正确、B错误,
故选B.
根据十字交叉法计算CH4、C3H8的体积比,

CH4和C3H8的体积之比为14:14=1:1,C2H6的体积为任意体积,所以ACD正确、B错误,
故选B.
点评:本题考查混合气体的计算,题目难度不大,关键在于清楚相同条件下气体的密度之比等于相对分子质量之比,注意差量法在化学计算中的应用.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
下列化合物中,同分异构体数目超过7个的有( )
| A、已烷 | B、已烯 |
| C、1,2-二溴丙烷 | D、乙酸乙酯 |
能正确表示下列反应的离子反应方程式为( )
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- |
| D、醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
由CO2和O2组成的混合气体,标准状况下的密度为1.5g?L-1,则该混合气体中CO2和O2的体积比为( )
| A、2:13 | B、13:2 |
| C、7:1 | D、1:7 |
用惰性电极电解饱和CuCl2溶液,下列说法正确的是( )
| A、电解过程中在阴极产生氯气 |
| B、该过程是化学能转化为电能 |
| C、在阳极有Cu生成 |
| D、生成的氯气可以用湿润的淀粉碘化钾试纸检测出 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A、P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
| B、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C、若M+和R2-的核外电子层结构相同,则原子序数R>M |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
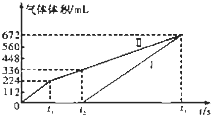 常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.
常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题. 表示的分子式
表示的分子式 中含有的官能团的名称为
中含有的官能团的名称为