题目内容
下列图象是表示铁跟一定量硝酸反应时,铁和硝酸铁之间物质的量(mol)的关系,其中正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:化学方程式的有关计算
专题:
分析:铁不足,发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,过量铁跟一定量硝酸反应最终生成硝酸亚铁,则Fe与硝酸的物质的量比大于1:4时发生2Fe(NO3)3+Fe=3Fe(NO3)2,两个阶段消耗铁不相同,以此来解答.
解答:
解:铁不足,发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,过量铁跟一定量硝酸反应最终生成硝酸亚铁,则Fe与硝酸的物质的量比大于1:4时发生2Fe(NO3)3+Fe=3Fe(NO3)2,即生成3molFe(NO3)2,消耗2molFe反应生成Fe(NO3)3,再消耗1molFe,都生成Fe(NO3)2,只有图象B符合,
故选B.
故选B.
点评:本题考查铁与硝酸的性质,把握发生的化学反应及图中两个阶段中铁的物质的量的关系为解答的关键,注意发生的氧化还原反应,题目难度中等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列反应的离子方程式不正确的是( )
| A、锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu |
| B、氢氧化钠溶液与盐酸反应:OH-+H+=H2O |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
下列图示的装置可以构成原电池的是( )
A、 稀H2SO 4 稀H2SO 4 |
B、 稀H2SO 4 |
C、 稀H2SO 4 |
D、 酒精 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A、最高价氧化物对应水化物的碱性A>C |
| B、氢化物的沸点H2D>H2E |
| C、单质与稀盐酸反应的速率A<B |
| D、C2+与A+的核外电子数相等 |
已知C+CO2?2CO,正反应是吸热反应,反应速率为v1;N2+3H2?2NH3,正反应是放热反应,反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、都增大 |
| B、都减小 |
| C、v1增大,v2减小 |
| D、v1减小,v2增大 |
常用的电池是一个液体电解质将两个固体电极隔开.而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法不正确的是( )
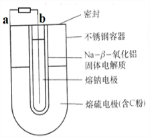

| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
下列粒子中,与OH-具有相同质子数和电子数的是( )
| A、Cl- |
| B、F- |
| C、NH3 |
| D、NH4+ |
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示.下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示.下列说法不正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 |
| B、状态A与状态B相比,状态A的c(I2)大 |
| C、若反应进行到状态D时,一定有V正>V逆 |
| D、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |


 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)