题目内容
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ?mo1—1、285.8kJ?mo1—1和393.5kJ?mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
(6分)每空2分。
(1)—74.8kJ?mol—1
(2)①H2O(l)=H2O(g) ΔH=
②
解析试题分析:(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=—890.3kJ?mo1—1,②H2(g)+1/2O2(g)=H2O(l) ΔH=—285.8kJ?mo1—1,③C(s)+O2(g)=CO2(g) ΔH=—393.5kJ?mo1—1,根据盖斯定律,由③+②×2—①可得:C(s)+2H2(g)=CH4(g) ΔH=—74.8kJ?mol—1;(2)根据盖斯定律,由①—②可得:2H2O(l)=2H2O(g) ΔH=ΔH2—ΔH1,则H2O(l)=H2O(g) ΔH=(ΔH2—ΔH1)/2;设CO和H2分别为xmol、ymol,则CO放出热量为—ΔH3×xmol/2,H2放出热量为—ΔH1×ymol/2,因此—ΔH3×xmol/2=—ΔH1×ymol/2,则x/y=ΔH1/ΔH3。
考点:考查燃烧热、热化学方程式、盖斯定律、反应热的计算等相关知识。

 阅读快车系列答案
阅读快车系列答案氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气: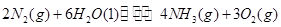
该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,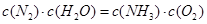 |
B.反应达到平衡后,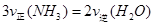 |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
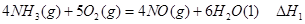 ①
①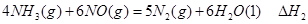 ②
②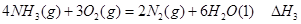 ③
③请写出上述三个反应中
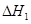 、
、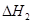 、
、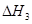 三者之间关系的表达式,
三者之间关系的表达式,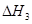 =_________。
=_________。(3)工业制硝酸的主要反应是:
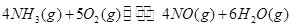
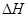 =
=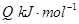
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 |  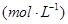 | 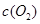 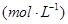 | 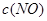 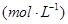 | 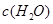 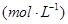 |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | a | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。

 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
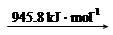 2N (g)
2N (g)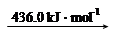 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的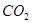 。
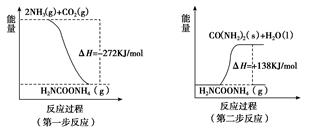
。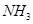 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①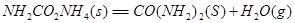
 ②
②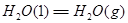
 ③
③ ,在催化剂作用下CO和
,在催化剂作用下CO和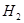 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol
 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)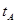 _______
_______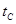 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)