题目内容
“节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的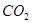 。
。
(1)使用过量 溶液吸收
溶液吸收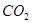 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L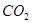 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以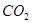 和
和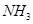 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①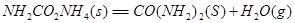
 ②
②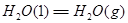
 ③
③
试写出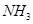 和
和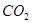 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
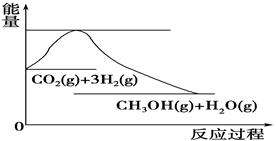
②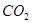 通过反应可转化为
通过反应可转化为 ,在催化剂作用下CO和
,在催化剂作用下CO和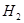 反应生成甲醇:
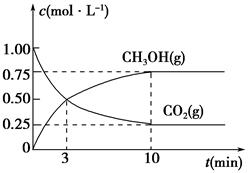
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol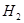 ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间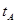 _______
_______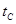 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
(1)CO2 + OH-=HCO3- c(Na+)=3[c(CO32—)+ c(HCO3—)+c(H2CO3)]
(2)①2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=—130.98KJ/mol;②a、0.01v2(mol.L-1)2 小于
b、> c、加压、降温或分离出甲醇
解析试题分析:(1)使用过量NaOH溶液吸收CO2生成碳酸氢钠,反应的离子方程式为CO2 + OH-=HCO3-
3molNaOH的溶液“捕捉”了1mol CO2气体,根据质量守恒定律钠是碳的3倍,所得溶液为碳酸钠和氢氧化钠的混合物,碳酸钠水解,溶液中含碳微粒有碳酸根、碳酸氢根和碳酸分子。钠与碳元素的物料守恒关系式为c(Na+)=3[c(CO32—)+ c(HCO3—)+c(H2CO3)];(2)①根据盖斯定律:①+②—③得NH3和CO2合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=—130.98KJ/mol;②a:A点对应的α=0.5,CO(g)+2H2(g)?CH3OH(g).
起始(mol) 10 20 0
转化(mol) 5 10 5
平衡(mol) 5 10 5
则K= C(CH3OH)/ C2(H2)C(CO),容器的体积为VL,代入数据计算得K=0.01v2(mol.L-1)2;B点与A点温度相同,B点压强大于A点,所以平衡状态B点时容器的容积VB小于VL;b、C点温度高于A点,温度越高反应速率越快,达平衡的时间越短,所以若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA>tB;C.在不改变反应物用量的情况下,为提高CO的转化率,根据平衡移动原理,可采取的措施是加压、降温或分离出甲醇。
考点:考查离子方程式书写、化学平衡计算及平衡移动原理。

(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
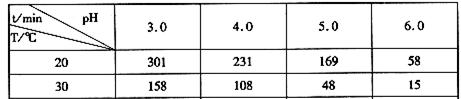
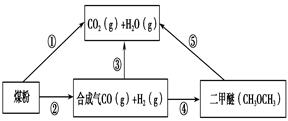
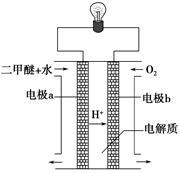
 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则: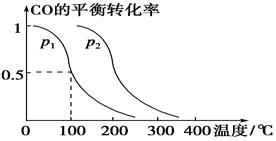
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol