题目内容
2.在下列反应中,水既不作氧化剂,又不作还原剂的是( )| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 |
分析 水作氧化剂时,H元素的化合价降低;水作还原剂时,O元素的化合价升高;水中H、O元素的化合价均变化,则既作氧化剂又作还原剂;水既不作氧化剂又不作还原剂,则反应前后水中H、O元素的化合价不变,据此分析.
解答 解:A.反应2Na+2H2O=2NaOH+H2↑中,水中氢元素化合价降低,只作氧化剂,故A错误;
B.反应Na2O+H2O═2NaOH中,水中的氢元素和氧元素化合价均未变化,所以水既不作氧化剂也不作还原剂,故B正确;
反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,水中H、O元素的化合价均变化,则既作氧化剂又作还原剂,故C错误;
反应C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2,水中氢元素化合价降低,只作氧化剂,故D错误;
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
12.下列气体不能用排水法收集的是( )
| A. | O2 | B. | NH3 | C. | CO | D. | H2 |
13.在含有较多NH4+、Ba2+、H+、Cl-的溶液中还能大量共存的离子是( )
| A. | SO42ˉ | B. | Mg2+ | C. | CH3COO- | D. | OHˉ |
10.在一定温度下,下列叙述不是可逆反应A(g)+3B(g)?2C(g)达到平衡的标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成a mol A,同时生成3a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
17.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
7.在PH=13的溶液中,下列各离子组可以大量共存的是( )
| A. | Na+、NO3-、H+、Ag+ | B. | K+、Fe3+、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、CO32- | D. | Na+、AlO2-、K+、Cl- |
14.下列离子方程式正确的是( )
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
11.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
| A. |  向容量瓶中转移溶液 | B. |  稀释浓硫酸 | ||
| C. |  制取氨气 | D. |  称取NaOH |
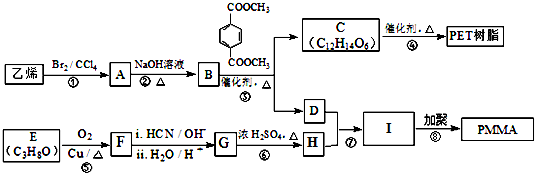
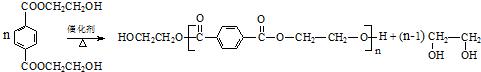
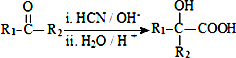 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)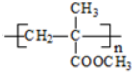 .
.