题目内容
【题目】下列各项中指定的比值是2∶1的是
A.金刚石晶体中C与C-C键的物质的量之比
B.K2S溶液中c(K+)与c(S2-)之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比
D.H2SO3溶液中阳、阴离子数比
【答案】C
【解析】
A.金刚石晶体中,每个C参与4条C-C键的形成,C原子数与C-C键之比为1:2,A项错误;
B.K2S为强碱弱酸盐,在水溶液中S2-会发生水解,故K2S溶液中c(K+)与c(S2-)之比大于2:1,B项错误;
C.Na2O2晶体中阳离子与阴离子分别为Na+、![]() ,故Na2O2晶体中阳离子与阴离子的物质的量之比2:1,C项正确;
,故Na2O2晶体中阳离子与阴离子的物质的量之比2:1,C项正确;
D.H2SO3为二元弱酸,分步部分电离,第二步电离很微弱。结合H2SO3溶液显弱酸性,根据电荷守恒有:c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),且c(
)+c(OH-),且c(![]() )>c(
)>c(![]() ),故H2SO3溶液中阳、阴离子数比不是2:1,D项错误;
),故H2SO3溶液中阳、阴离子数比不是2:1,D项错误;
答案选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】对工业废气进行脱硝有多种方法。
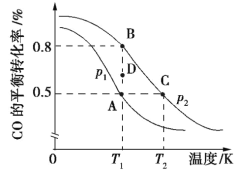
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
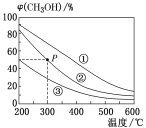
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
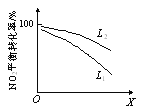
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。