题目内容
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
【答案】D
【解析】
A选项,标准状况下,11.2 L Cl2物质的量为0.5mol,氯气与水反应是可逆反应,根据物料守恒得出溶液中Cl-,ClO-和HClO的微粒数之和小于NA,故A错误;
B选项,32.5 g FeCl3物质的量为0.2mol,其水解形成Fe(OH)3胶体,胶体粒子是聚合体,因此胶体粒子数小于0.2NA,故B错误;
C选项,1 mol PC13与1 mol 36C12反应达到平衡时,反应是可逆反应,产物PC15的物质的量小于1mol,因此PC15中含P—36C1键数目小于为2NA,故C错误;
D选项,根据反应式知x=3,即反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 即1mol,则释放的中子数为3NA,故D正确;
即1mol,则释放的中子数为3NA,故D正确;
综上所述,答案为D。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】某活动小组在实验室探究氨气的的制备方法,并测定其分子组成。
![]() 同学甲用下图所示装置制备氨气。
同学甲用下图所示装置制备氨气。
已知:加热![]() 和
和![]() 饱和溶液可以制取
饱和溶液可以制取![]() 。
。
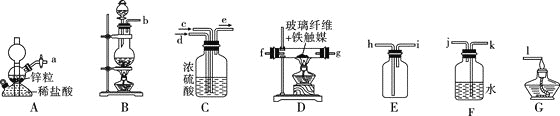
(1)![]() 、D、G处的酒精灯最先点燃的是 ___________
、D、G处的酒精灯最先点燃的是 ___________![]() 填字母
填字母![]() 。
。
(2)写出B中制取![]() 的反应的离子方程式:__________。
的反应的离子方程式:__________。
(3)图示装置从左到右正确连接顺序:![]()
![]() ____
____![]() ____
____![]() ____
____![]() ____
____![]() 。
。
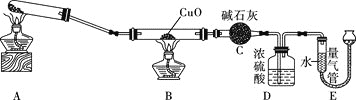
![]() 同学乙用下图所示装置
同学乙用下图所示装置![]() 夹持装置已省略
夹持装置已省略![]() 制备氨气,并与CuO反应测定氨气的组成。
制备氨气,并与CuO反应测定氨气的组成。
(1)同学乙在相同条件下,选择不同固体试剂制取氨气,实验数据如下:
实验方案 | 固体试剂 |
| |
1 |
|
| 1753 |
2 |
| 1892 | |
3 |
|
| 1354 |
4 |
| 1384 | |
分析表中数据,你认为哪种方案制取氨气的效果最好?________![]() 填序号
填序号![]() ,该方案制取氨气效果好的可能原因是_______________。
,该方案制取氨气效果好的可能原因是_______________。
(2)装置D的作用是______________________________________。
(3)实验结束后,若测得干燥管C增重![]() ,装置E中气体的体积为
,装置E中气体的体积为![]() 已折算为标准状况
已折算为标准状况![]() ,则氨分子中氮、氢的原子个数比为___________
,则氨分子中氮、氢的原子个数比为___________![]() 用含m、V的代数式表示
用含m、V的代数式表示![]() ;若测量时,发现E装置中液面左低右高,则测得的比值___________
;若测量时,发现E装置中液面左低右高,则测得的比值___________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。
【题目】某实验小组为探究![]() 漂白性的原因进行如下实验。已知
漂白性的原因进行如下实验。已知![]() 易溶于水,能溶于乙醇。
易溶于水,能溶于乙醇。![]() 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
![]()
![]() ;
;
![]()
![]() 。
。
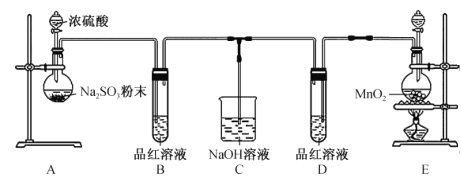
实验室用亚硫酸钠粉末与硫酸制取![]() ,装置如图
,装置如图![]() 气密性良好
气密性良好![]() 。
。

(1)盛装![]() 的硫酸的仪器名称是________。使用
的硫酸的仪器名称是________。使用![]() 的硫酸比用
的硫酸比用![]() 的硫酸反应效果好,其原因是________。装置B的作用是________。
的硫酸反应效果好,其原因是________。装置B的作用是________。
(2)第一次实验:
C装置中混合溶液 | 品红的水溶液 | 品红的乙醇溶液 |
实验现象 | 红色褪去 | 无变化 |
从上述实验可知使品红水溶液褪色的微粒可能为________![]() 写出两种即可
写出两种即可![]() 。
。
(3)实验小组为进一步探究![]() 是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入
是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入![]() 气体,C装置中品红水溶液褪色。以上实验______
气体,C装置中品红水溶液褪色。以上实验______![]() 填“能“或“不能”
填“能“或“不能”![]() 证明
证明![]() 是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
(4)请你设计探究![]() 是使品红水溶液褪色的原因之一的实验方案:________。
是使品红水溶液褪色的原因之一的实验方案:________。