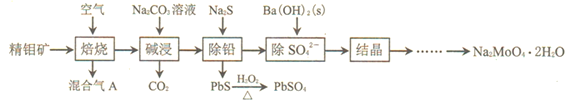
��Ŀ����
����Ŀ����������������Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1���������ɼ����Ʊ�:CH4 (g)+H2O(l)![]() CO(g)+3H2 (g)��H=+250.1 kJ��mol-1����֪298 Kʱ��CH4(g)��CO(g)��ȼ���ȷֱ�Ϊ890 kJ��mol-1��283 kJ��mol-1��д������ȼ���ȵ��Ȼ�ѧ����ʽ___________��
CO(g)+3H2 (g)��H=+250.1 kJ��mol-1����֪298 Kʱ��CH4(g)��CO(g)��ȼ���ȷֱ�Ϊ890 kJ��mol-1��283 kJ��mol-1��д������ȼ���ȵ��Ȼ�ѧ����ʽ___________��
��2�����÷�ӦCO(g)+2H2(g)![]() CH3OH(g) ����H�ϳ������ԴCH3OH��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
CH3OH(g) ����H�ϳ������ԴCH3OH��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
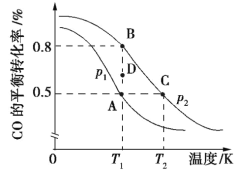
�ٸÿ��淴Ӧ������Ӧ��H______0�� A��B��C����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ��_____�� ѹǿp1___p2(����>����<������=��)�� ��T1��p2�����£���D�㵽B������У������淴Ӧ����֮��Ĺ�ϵ: v��___v��(����>����<������=��)��
�����ں��º��������½���������Ӧ���ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����_____________________ (�����)��
a.CO���ʵ������ֲ���
b.��λʱ��������CO��Ũ�Ⱥ����ɼ״���Ũ�����
c.��������ѹǿ���ٱ仯
d.���������ܶȲ��ٱ仯
����2 L�����ܱ������г���2 mol CO��4 mol H2����p2 (��T2�����¾�10 min�ﵽƽ��״̬C�㣬�ڸ������£�v(CH3OH)=______________________��ƽ�ⳣ��KΪ_________________________________
���𰸡�H2(g)+![]() O2(g)
O2(g)![]() H2O(l)����H=-285.7 kJ��mol-1 < KA=KB>KC < > ac 0.05 mol��L-1��min-1 1 L2��mol-2
H2O(l)����H=-285.7 kJ��mol-1 < KA=KB>KC < > ac 0.05 mol��L-1��min-1 1 L2��mol-2
��������
��1������һ�����͵ĸ�˹���ɵ�Ӧ�ã������������������в������ɣ�
��2��������ͼ���Կ�������ѹǿһ��������£��¶�Խ�߷�Ӧ���ת����Խ�ͣ���Խ��Խ����Ӧ��������Ӧ�Ƿ��ȵģ����¶�һ��������£�p1��ת����û��p2�ߣ�����Ӧ��������������ٵģ����ѹǿԽ������Ӧ���е�Խ���ף���p2��ѹǿ����p1���ݴ����������ɣ�
��1���г�����ʽ�ӣ���![]() ����
����![]() ����
����![]() ���ٸ��ݸ�˹���ɣ���(�ڣ��٣���)��3�õ�
���ٸ��ݸ�˹���ɣ���(�ڣ��٣���)��3�õ�![]() ��
��
��2���ٴ�ͼ���п��Կ����������¶����ߣ�CO��ƽ��ת���ʽ��ͣ�˵������Ӧ�Ƿ��ȷ�Ӧ��Kֻ���¶��йأ�A��B�����¶���ͬ��K��ͬ��B��C����ѹǿ��ͬ����T1<T2�������¶ȣ�K��С����KA��KB>KC���¶���ͬ������ѹǿ��CO��ƽ��ת��������p1<p2��D�㵽B��(δƽ��״̬��ƽ��״̬)CO��ת������������Ӧ���ʴ����淴Ӧ���ʣ�
��a.CO�����ʵ������䣬��Ũ�Ȳ��䣬˵����Ӧ�ﵽƽ��״̬��a��ȷ��
b.��λʱ��������CO��Ũ�Ⱥ����ɼ״���Ũ�ȱ�Ȼ��ȣ�b����
c.��������ѹǿ���䣬˵�������ʵ�Ũ�Ȳ��䣬�ʷ�Ӧ�ﵽƽ��״̬��c��ȷ��
d.���������ܶ�ʼ�ղ��䣬�ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬��d����;
��ѡac��
����2 L�����ܱ������г���2 mol CO��4 mol H2����p2 (��T2�����¾�10 min�ﵽƽ��״̬C�㣬�ڸ������£�CO��ƽ��ת����Ϊ0.5����![]() ��CO�� H2����CH3OH��ƽ�ⳣ��Ũ�ȷֱ�Ϊ��0.5mol/L��1mol/L��0.5mol/L����ˣ�
��CO�� H2����CH3OH��ƽ�ⳣ��Ũ�ȷֱ�Ϊ��0.5mol/L��1mol/L��0.5mol/L����ˣ�![]() ��
��