题目内容
10.由某精矿石(MCO3•ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇.取该矿石样1.84g,高温灼烧至恒重,得到0.96g仅含两种金属氧化物的固体,其中m(M):m(Z)=3:5.请回答:(1)该矿石的化学式为MgCO3•CaCO3;
(2)以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2:1,写出该反应的化学方程式2MgO+2CaO+Si$\frac{\underline{\;真空高温\;}}{\;}$2Mg+Ca2SiO4.
分析 (1)由于M和Z的相对原子质量之比为3:5,故设M和Z的相对原子质量分别为3x,5x.
由于MCO3•ZCO3中MCO3和ZCO3的比值为1:1,故得到的氧化物MO和ZO的物质的量之比也为1:1,根据MCO3•ZCO3的质量为1.84g,得到氧化物的质量为0.96g,可得:
$\frac{3x+5x+32}{3x+5x+120}=\frac{0.96}{1.84}$,即可解得x值,从而得出M和Z的相对原子质量,并得出矿石的化学式;
(2)由于灼烧后的产物为CaO和MgO的混合物,而真空高温条件下用单质硅还原,仅得到单质Mg和一种含氧酸盐,据此写出化学方程式.
解答 解:(1)由于M和Z的相对原子质量之比为3:5,故设M和Z的相对原子质量分别为3x,5x.
由于MCO3•ZCO3中MCO3和ZCO3的物质的量之比为1:1,故得到的氧化物中MO和ZO的物质的量之比也为1:1,根据MCO3•ZCO3的质量为1.84g,得到氧化物的质量为0.96g,可得:
$\frac{3x+5x+32}{3x+5x+120}=\frac{0.96}{1.84}$,x=8,
M的相对原子质量为3x=24,故M为Mg,
Z的相对原子质量为5x=40,故Z为Ca,则矿石的化学式为MgCO3•CaCO3,故答案为:MgCO3•CaCO3;
(2)由于灼烧后的产物为CaO和MgO的混合物,而真空高温条件下用单质硅还原,仅得到单质Mg和一种含氧酸盐,由于此含氧酸盐中只含Z、Si和O元素,且Z和Si的物质的量之比为2:1,故为Ca2SiO4,故此反应的化学方程式为:2MgO+2CaO+Si$\frac{\underline{\;真空高温\;}}{\;}$2Mg+Ca2SiO4,故答案为:2MgO+2CaO+Si$\frac{\underline{\;真空高温\;}}{\;}$2Mg+Ca2SiO4;
点评 本题考查了复杂化合物的化学式的确定和化学方程式的书写,难度较大,理清思路是关键.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 原子晶体中只存在非极性共价键 | |
| B. | 干冰升华时,分子内共价键会发生断裂 | |
| C. | 由原子构成的晶体可以是原子晶体,也可以是分子晶体 | |
| D. | 只要含有金属阳离子的晶体就一定是离子晶体 |
①离子还原性:S2->I->Fe2+>Br-
②氢化物沸点HF<HCl<HBr
③酸性:H2SO4>HClO4
④非金属性:F>Cl>S.
| A. | ②④ | B. | ①④ | C. | ①②③ | D. | 只有④ |
| A. | C22-的电子式是[ ]2- ]2- | |
| B. | Mg2C3和Li2C2与水反应生成的烃可能具有相同的官能团 | |
| C. | 1mol ZnC2与水反应生成的烃的体积约为22.4L | |
| D. | Al4C3与水反应生成的烃分子中只有极性键 |
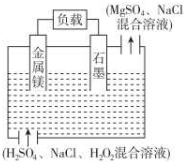 镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )
镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )| A. | 镁作该电源负极,发生反应Mg-2e-═Mg2+ | |
| B. | 该电池反应方程式:Mg+H2O2+2H+═Mg2++2H2O | |
| C. | 放电时溶液中的Cl-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
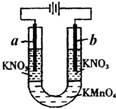 如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
 硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下: