题目内容
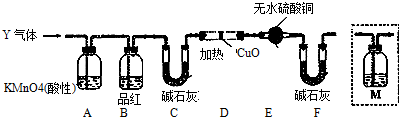
13.下列实验设计能达到相应实验目的是( )| A. |  用图所示装置制取干燥纯净的氨气 | |
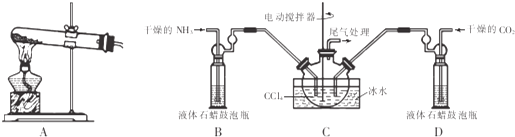
| B. |  用图所示装置制备并观察氢氧化亚铁的颜色 | |
| C. | 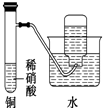 为制备并收集少量NO2气体 | |
| D. |  量取0.10 mol•L-1KOH溶液20.00 mL |
分析 A.氨气密度小于空气,应该采用向下排空气法收集;
B.用电解法制取氢氧化亚铁时需要Fe做阳极;
C.稀硝酸和铜反应生成NO,且二氧化氮能和水反应;
D.碱式滴定管只能盛放碱性溶液,且滴定管感量为0.01mL.
解答 解:A.氨气密度小于空气,应该采用向下排空气法收集,所以集气瓶应该倒置,故A错误;
B.用电解法制取氢氧化亚铁时需要Fe做阳极,阳极上Fe失电子生成亚铁离子,阴极上水得电子生成氢气和氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,故B错误;
C.稀硝酸和铜反应生成NO,且二氧化氮能和水反应,NO不易溶于水,应该用浓硝酸和Cu反应制取二氧化氮,且采用向上排空气法收集,故C错误;
D.碱式滴定管只能盛放碱性溶液,且滴定管感量为0.01mL,NaOH溶于呈碱性,应该用碱式滴定管量取,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器使用、气体制备和收集、物质制备等知识点,明确实验原理及物质性质是解本题关键,会根据气体密度和性质选取合适的收集方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列有机物的结构表示不正确的是( )
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: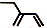 |
1.下列属于吸热反应的是( )
| A. | 镁的燃烧反应 | B. | 盐酸与氢氧化钠的反应 | ||
| C. | 水的分解反应 | D. | 铝与盐酸的反应 |
8.化学与我们人类生活息息相关,下列说法不正确的是( )
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 生活中常使用热的纯碱溶液去除油污 | |
| C. | 明矾具有强氧化性,常用于自来水的杀菌消毒 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
18.下列有关说法正确的是( )
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
5.过氧化钙晶体CaO2•8H2O较稳定,呈白色,微溶于水,能溶于酸性溶液.广泛应用于环境杀菌、消毒等领域.过氧化钙晶体含量的测定(假定杂质不发生反应)
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol•L-1 H2SO4,
发生化学反应:CaO2•8H2O+H2SO4═CaSO4+H2O2+8H2O用0.0200mol•L-1KMnO4
标准溶液滴定至终点.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O重复上述操作两次.
(1)在滴定过程中,没有选用指示剂是因为高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色.
(2)滴定终点观察到的现象为当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色.
(3)根据表中的数据,计算产品中CaO2•8H2O的质量分数(写出计算过程)
(4)用KMnO4溶液做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,若用放置了两周的KMnO4标准溶液去测定产品中CaO2•8H2O的质量分数,则测得的值将偏高(填“偏高”或“偏低”)
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol•L-1 H2SO4,
发生化学反应:CaO2•8H2O+H2SO4═CaSO4+H2O2+8H2O用0.0200mol•L-1KMnO4
标准溶液滴定至终点.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O重复上述操作两次.
(1)在滴定过程中,没有选用指示剂是因为高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色.
(2)滴定终点观察到的现象为当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色.
(3)根据表中的数据,计算产品中CaO2•8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
4.中和热的测定实验中,可能用到下列仪器.其中应使用仪器的正确组合是( )
①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.
①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.
| A. | ①②⑤ | B. | ②③④ | C. | ②③⑥ | D. | 全部 |