题目内容
有一瓶溶液,其中可能含有H+、N
、K+、Mg2+、Ba2+、Fe3+、S
、C
和I-.取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;根据上述实验事实,可知该溶液中肯定含有的离子是 ;肯定没有的离子是 ;还不能确定是否含有的离子是 .
写出步骤(2)中反应的离子方程式 .
写出步骤(5)中反应的离子方程式 .
| H | + 4 |
| O | 2- 4 |
| O | 2- 3 |
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;根据上述实验事实,可知该溶液中肯定含有的离子是
写出步骤(2)中反应的离子方程式
写出步骤(5)中反应的离子方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)溶液呈强酸性,含有H+,那么C
不能存在;
(2)溶液中加入数滴氯水及2mL CCl4,振荡后CCl4层呈紫红色,溶液中含有I-,那么不能含有Fe3+(与碘离子发生氧化还原反应);
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,则一定不含有Mg2+;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,则一定含有Ba2+,那么不能含有SO 42-;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,那么一定含有N
据此解答即可.
| O | 2- 3 |
(2)溶液中加入数滴氯水及2mL CCl4,振荡后CCl4层呈紫红色,溶液中含有I-,那么不能含有Fe3+(与碘离子发生氧化还原反应);
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,则一定不含有Mg2+;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,则一定含有Ba2+,那么不能含有SO 42-;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,那么一定含有N
| H | + 4 |
解答:
解:(1)溶液呈强酸性,含有H+,那么C
不能存在;
(2)溶液中加入数滴氯水及2mL CCl4,振荡后CCl4层呈紫红色,溶液中含有I-,那么不能含有Fe3+(与碘离子发生氧化还原反应);
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,则一定不含有Mg2+;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,则一定含有Ba2+,那么不能含有SO 42-;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,那么一定含有N
,综合以上分析:
溶液中一定存在:H+、N
、Ba2+、I-,肯定没有的离子是:Mg2+、Fe3+、S
、C
;还不能确定是否含有的离子是 K+,(2)中是碘离子被氧化,故离子反应方程式为:Cl2+2I-=2Cl-+I2;(5)中是铵根与氢氧根反应放出氨气,离子反应方程式为:NH4++OH-
NH3↑+H2O,故答案为:H+、N
、Ba2+、I-;Mg2+、Fe3+、S
、C
;K+;Cl2+2I-=2Cl-+I2;NH4++OH-
NH3↑+H2O.
| O | 2- 3 |
(2)溶液中加入数滴氯水及2mL CCl4,振荡后CCl4层呈紫红色,溶液中含有I-,那么不能含有Fe3+(与碘离子发生氧化还原反应);
(3)另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,则一定不含有Mg2+;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,则一定含有Ba2+,那么不能含有SO 42-;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,那么一定含有N
| H | + 4 |
溶液中一定存在:H+、N
| H | + 4 |
| O | 2- 4 |
| O | 2- 3 |
| ||
| H | + 4 |
| O | 2- 4 |
| O | 2- 3 |
| ||
点评:本题主要考查的是常见离子的检验,利用离子不能共存,确定一种并否定一种或几种,掌握此方法.

练习册系列答案
相关题目
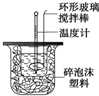 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: