题目内容
5.下列物质暴露在空气中,不容易变质的是( )| A. | Na | B. | FeSO4 | C. | SiO2 | D. | Na2O2 |
分析 根据物质的性质进行分析,变质就是在空气中发生了化学变化,即与空气中的氧气、水或二氧化碳等发生反应,据此分析.
解答 解:A.钠是非常活泼的金属单质,在空气中能与氧气会水蒸气反应,暴露在空气中易变质,故A不选;
B.FeSO4具有较强的还原性,能被空气中的氧气氧化,所以不能暴露在空气,故B不选;
C.SiO2性质稳定,与空气中的氧气、水或二氧化碳等不发生反应,在空气中不易变质,故C选;
D.过氧化钠能够与二氧化碳、水反应,暴露在空气中容易变质,故D不选;
故选:C.
点评 本题考查了物质的性质、物质的保存,明确物质的性质是解题关键,侧重考查学生对基础知识掌握的熟练程度,题目难度不大.

练习册系列答案
相关题目
15.下列实验操作中,正确的是( )
| A. | 为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 为加速固体物质的溶解可采用研磨、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌,加热等措施 |
16.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Mg2+、Na+、SO42-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Na+、K+、OH-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
13. 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ |
10.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 22.4L氯气和氢气的混合气体含有2NA个原子 | |
| B. | 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 1molFeI2与1molCl2反应转移的电子数为2NA |
4. 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
5.下列能达到实验目的是( )


| A. | 图①用于除Cl2中混有的HCl气体 | |
| B. | 图②可用于制取并收集少量NO2气体 | |
| C. | 图③所示实验装置可用排空气法收集CO2 | |
| D. | 图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |

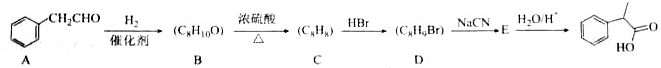
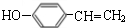 .
.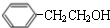 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$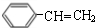 +H2O;C→D的反应类型为加成反应
+H2O;C→D的反应类型为加成反应 .
.