题目内容
某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法正确的是( )
| A、该溶液可由等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合而成该溶液 |
| B、可由pH=3的HCl与pH=11的NH3?H2O溶液等体积混合而成 |
| C、若溶液中离子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) 溶液中溶质一定含有NH4Cl |
| D、加入适量NH3?H2O,溶液中离子浓度可能为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合,反应恰好生成氯化铵,铵离子水解,溶液显示酸性;
B、pH=3的HCl与pH=11的NH3?H2O溶液等体积混合,氨水过量,溶液显示碱性;
C、根据离子浓度关系可知,该溶液可能为氯化铵溶液,有可能为氯化铵和氯化氢的混合物;
D、根据溶液中一定遵循电荷守恒进行判断.
B、pH=3的HCl与pH=11的NH3?H2O溶液等体积混合,氨水过量,溶液显示碱性;
C、根据离子浓度关系可知,该溶液可能为氯化铵溶液,有可能为氯化铵和氯化氢的混合物;
D、根据溶液中一定遵循电荷守恒进行判断.
解答:
解:A、由等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合后,反应生成氯化铵溶液,铵根离子部分水解,溶液显示酸性,故A正确;
B、一水合氨为弱电解质,pH=3的盐酸与pH=11的氨水等体积混合,氨水过量,溶液呈碱性,故B错误;
C、由离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)可知,溶质可能为氯化铵,有可能为氯化铵和氯化氢的混合物,所以溶液中一定存在氯化铵,故C正确;
D、溶液电荷不守恒,如c(H+)>c(OH-),应有c(C1-)>c(NH4+),或c(OH-)>c(H+),应有c(NH4+)>c(C1-),故D错误;
故选AC.
B、一水合氨为弱电解质,pH=3的盐酸与pH=11的氨水等体积混合,氨水过量,溶液呈碱性,故B错误;
C、由离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)可知,溶质可能为氯化铵,有可能为氯化铵和氯化氢的混合物,所以溶液中一定存在氯化铵,故C正确;
D、溶液电荷不守恒,如c(H+)>c(OH-),应有c(C1-)>c(NH4+),或c(OH-)>c(H+),应有c(NH4+)>c(C1-),故D错误;
故选AC.
点评:本题考查离子浓度大小比较、盐的水解原理,题目难度中等,注意一水合氨为弱电解质的特点以及从溶液电中性的角度分析,掌握电荷守恒、物料守恒在离子浓度大小比较中的应用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
背景材料:(1)2011年10月30日,湘潭市畜产品安全检测中心检测到市场上有假猪耳朵:黑心商贩使用化学物质(海藻酸钠、明矾、氧化钙等)制造,其中的明矾能引起恶心、呕吐、老年痴呆和慢性中毒,食用假猪耳朵对人体健康有害;
(2)2011年11月3日1点30分,中国自行研制的“神舟八号”飞船与“天宫一号”目标飞行器实现刚性连接,形成组合体,中国载人航天首次空间交会对接试验获得成功;
(3)“黄金有价玉无价”,北京奥运奖牌“金镶玉”中玉的成分主要为含水钙镁硅酸盐;
(4)人民网10月14日报道国家质检总局称阴极铜(粗铜经过电解后的产品)抽样合格率为100%.
以下说法中不正确的是( )
(2)2011年11月3日1点30分,中国自行研制的“神舟八号”飞船与“天宫一号”目标飞行器实现刚性连接,形成组合体,中国载人航天首次空间交会对接试验获得成功;
(3)“黄金有价玉无价”,北京奥运奖牌“金镶玉”中玉的成分主要为含水钙镁硅酸盐;
(4)人民网10月14日报道国家质检总局称阴极铜(粗铜经过电解后的产品)抽样合格率为100%.
以下说法中不正确的是( )
| A、明矾可用来净水却不能降低水的硬度,其净水原理是:KAl(SO4)2═K++Al3++SO42-;Al3++3H2O?Al(OH)3(胶体)+3H+ |
| B、在粗铜的电解精炼中,粗铜为电解池的阴极,纯铜为电解池的阳极 |
| C、某硅酸盐Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO?5MgO?8SiO2?H2O |
| D、若火箭推进器中发生:H2N-N(CH3)2+2N2O4═3N2+2CO2+4H2O反应.则每生成3mol 氮气,转移电子的物质的量为16mol |
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10、5.4×10-13、8.5×10-17,下列说法错误的是( )
| A、常温下在水中的溶解能力AgCl>AgBr>AgI |
| B、在AgCl饱和溶液中加入饱和NaBr溶液有AgBr沉淀生成 |
| C、在AgBr饱和溶液中加入饱和NaCl溶液有AgCl沉淀生成 |
| D、将AgCl、AgBr和AgI的饱和溶液等体积混合,再加入足量的浓AgNO3,溶液,生成的AgI沉淀最多 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
| B、标准状况下,22.4LH2O含有的分子数为1 NA |
| C、5.6g的Fe和足量的盐酸反应时,失去的电子数为0.2 NA |
| D、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA |
| B、标准状况下,22.4LSO3含有的分子数为NA |
| C、1mol二氧化硅中含有的Si-O键数目为2NA |
| D、16.9 g BaO2晶体中阴、阳离子总数为0.2NA |
25℃时,下列各物质的水溶液的pH小于7的是( )
| A、Na2CO3 |
| B、KOH |
| C、Fe2(SO4)3 |
| D、KHCO3 |

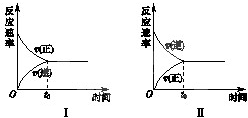 t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:
t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示: