题目内容
3.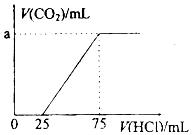 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )| A. | 原溶液中NaOH的物质的量为0.75mol | |
| B. | 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 | |
| C. | 通入CO2后所得的溶液中含有2.5mol NaHCO3 | |
| D. | 原溶液通入CO2标准状况下为112mL |
分析 盐酸逐滴加入到碳酸钠溶液中的反应为:Na2CO3+HCl=NaCl+NaHCO3;NaHCO3+HCl=NaCl+CO2↑+H2O,由图可知,0~25mL没有气体生成,从25mL开始加盐酸生成二氧化碳气体,共消耗盐酸75mL-20mL=50mL,0~25mL段消耗的盐酸体积小于生成气体是消耗的盐酸体积50mL,所以可以知道通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3,且根据消耗的盐酸的体积可以判断二者的物质的量相等.
A、消耗盐酸75mL时,溶液为恰好为氯化钠溶液,根据Na+、Cl-离子守恒,可知n(NaOH)=n(NaCl)=n(HCl),据此计算;
B、通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3;
C、溶液中Na2CO3、NaHCO3的物质的量相等,生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL-20mL=50mL,n总(NaHCO3)=
n(HCl),根据碳元素守恒可知通入CO2后所得的溶液中含有NaHCO3为$\frac{1}{2}$n总(NaHCO3),据此计算;
D、由C得n(NaHCO3)=n(Na2CO3)=2.5×10-3mol,根据碳元素守恒,则n(CO2)=n(NaHCO3)+n(Na2CO3)=0.005mol,V(CO2)=n(CO2)Vm=0.005mol×22.4L/mol=112ml,据此分析.
解答 解:盐酸逐滴加入到碳酸钠溶液中的反应为:Na2CO3+HCl=NaCl+NaHCO3;NaHCO3+HCl=NaCl+CO2↑+H2O,由图可知,0~25mL没有气体生成,从25mL开始加盐酸生成二氧化碳气体,共消耗盐酸75mL-20mL=50mL,0~25mL段消耗的盐酸体积小于生成气体是消耗的盐酸体积50mL,所以可以知道通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3,且根据消耗的盐酸的体积可以判断二者的物质的量相等.
A、消耗盐酸75mL时,溶液为恰好为氯化钠溶液,根据Na+、Cl-离子守恒,可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故A错误;
B、由上述分析可知,通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3,故B错误;
C、溶液中Na2CO3、NaHCO3的物质的量相等,生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL-20mL=50mL,n总(NaHCO3)=n(HCl)=0.05L×0.1mol/L=0.005mol,所以通入CO2后所得的溶液中含有NaHCO3为0.005mol×$\frac{1}{2}$=2.5×10-3mol,故C错误;
D、由C得n(NaHCO3)=n(Na2CO3)=2.5×10-3mol,根据碳元素守恒,则n(CO2)=n(NaHCO3)+n(Na2CO3)=0.005mol,V(CO2)=n(CO2)Vm=0.005mol×22.4L/mol=112ml,故D正确.
故选D.
点评 本题考查学生根据图象获取信息的能力、混合物的计算等,难度中等,根据图象判断溶质及各段发生的反应是解题的关键,注意原子守恒的方法来进行计算.

 ,其分子结构中处在同一平面内的原子最多有( )
,其分子结构中处在同一平面内的原子最多有( )| A. | 15个 | B. | 16个 | C. | 17个 | D. | 18个 |
| A. | 燃着的酒精灯打翻失火,立即用水浇灭 | |
| B. | 若不慎将浓碱液沾在皮肤上,立即用大量水冲洗,再涂上适量的稀硼酸溶液 | |
| C. | 用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 | |
| D. | 配制稀硫酸时,可先在量筒中加入一定量的水,再在搅拌下缓慢加入浓硫酸 |
| A. | 采取低碳、节俭的生活方式 | B. | 按规定对生活废弃物进行分类放置 | ||
| C. | 经常使用一次性筷子、塑料袋 | D. | 深入农村和社区,加强环保宣传 |
| A. | 五氯化磷 | B. | 六氟化硫 | C. | 三氯化硼 | D. | 光气(COCl2) |
| A. | NaCl | B. | H2 | C. | H2O | D. | NaOH |