题目内容
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡继续通入Cl2,逆反应速率____(填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(NO的结构为:N≡O;亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol则a=______。
2ClNO(g) △H=-111kJ/mol则a=______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
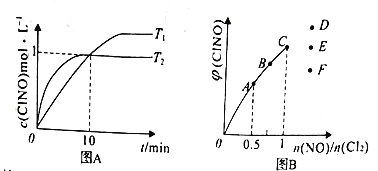
①该反应的T1______T2(填“>”<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=_______mol/(L.min)。
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是_____点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____点。
【答案】 增大 200 < 0.1 2 A D
【解析】(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,压强增大,逆反应速率增大;(2)2NO(g)+Cl2(g)![]() 2ClNO(g) 反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=-111kJ/mol,解得a=200;(3)根据图A可知,T2条件下反应先达平衡,则T1<T2;②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=1mol/L10min1mol/L10min=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min);
2ClNO(g) 反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=-111kJ/mol,解得a=200;(3)根据图A可知,T2条件下反应先达平衡,则T1<T2;②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=1mol/L10min1mol/L10min=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min);
③2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始(mol/L)210
改变(mol/L)10.51
平衡(mol/L)10.51
T2时该反应的平衡常数K= ![]() =
=![]() =2;(4)n(NO)/n(C12)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(C12)=1.5,达到平衡状态ClNO的体积分数是D。
=2;(4)n(NO)/n(C12)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(C12)=1.5,达到平衡状态ClNO的体积分数是D。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案