题目内容
1.下列关于离子键、共价键的叙述中正确的是( )| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 由多种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
分析 A、离子化合物中可能含有共价键;
B、非极性键可能存在于多原子的化合物里;
C、由不同元素组成的多原子分子可能存在非极性键;
D、只含有共价键的化合物是共价化合物.
解答 解:A、离子化合物里一定含有离子键,可能含有共价键,如硫酸钠中既含离子键也含共价键,故A错误;
B、非极性键可能存在于多原子的化合物里,如乙烷中碳原子和碳原子之间存在非极性共价键,故B错误;
C、由不同元素组成的多原子分子可能存在非极性键,如双氧水中氧原子和氧原子之间存在非极性共价键,故C错误;
D、只含有共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故D正确;
故选D.
点评 本题考查了化学键类型和化合物类型的关系,难度不大,注意:不是所有的物质都含有化学键,稀有气体中不存在化学键,只存在分子间作用力.

练习册系列答案
相关题目
9.下列关于有机物的说法中,正确的是( )
| A. | 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 | |
| B. | 用新制的银氨溶液可区分甲酸乙酯和乙醛 | |
| C. | 油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙酸乙酯、油脂、果糖、蛋白质都可以发生水解反应 |
16.麦角醇在紫外光照射下可转化为抗软骨病的维生素D2,麦角醇的结构简式如图所示.下列关于该化合物的说法正确的是( )

| A. | 属于芳香族化合物 | B. | 分子式为C27H40O | ||
| C. | 能发生加成反应和取代反应 | D. | 不能使酸性KMnO4溶液褪色 |
6.下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
| A. |  实验室制乙烯 | |
| B. |  实验室制乙炔并验证乙炔发生氧化反应 | |
| C. |  实验室中分馏石油 | |
| D. |  若a为醋酸,b为贝壳(粉状),c为苯酚钠溶液,验证醋酸、碳酸、苯酚酸性的强弱 |
13.下列各种醇不能被氧化的是( )
| A. | CH3OH | B. |  | C. |  | D. |  |
10.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O(未配平),下列有关说法正确的是( )
+H2O(未配平),下列有关说法正确的是( )
 +H2O(未配平),下列有关说法正确的是( )
+H2O(未配平),下列有关说法正确的是( )| A. | 该反应属于中和反应 | B. | 三聚氰胺的分子式为C3H6N3O3 | ||
| C. | 三聚氰胺分子中只有极性键 | D. | 三聚氰胺属于离子化合物 |
11.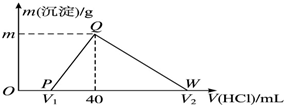 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )| A. | OP段发生的反应为:OH-+H+═H2O | B. | 图中V2为100 | ||
| C. | 沉淀的质量m为1.56 g | D. | 原合金质量为0.92 g |
