题目内容
20.下列各组物质中,化学键的类型(离子键、共价键)完全相同的是( )| A. | H2O和SO2 | B. | HCl和KCl | C. | Na2O2和 H2O2 | D. | NH4F和NaF |
分析 一般来说,活泼金属与活泼非金属形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A、二氧化硫和水都为共价化合物,含有共价键,且晶体类型为分子晶体,故A正确;
B、HCl中含有共价键和KCl中含有离子键,故B错误;
C、Na2O2中含有共价键和离子键,而H2O2中只含有共价键,故C错误;
D、NH4F中含有共价键和离子键,而NaF中只含有离子键,故D错误;
故选A.
点评 本题考查了化学键类型和晶体类型的关系,注意判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键,题目难度不大.

练习册系列答案
相关题目
8.136C-NMR(核磁共振)可以用于含碳化合物的结构分析,请分析136C的碳原子( )
| A. | 核内有6个质子,核外有13个电子 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
15.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98g/mol | |
| B. | 2 mol H2O和2 mol NH3含电子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数不同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
5.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| B. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| C. | 电解熔融NaCl,阴极的电极反应式为:2Cl--2e-=Cl2↑ | |
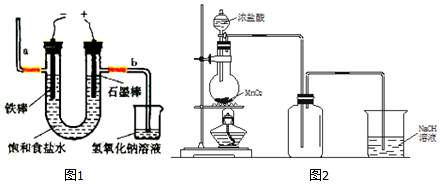
| D. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
12.下列实验能达到预期目的是( )
| A. | 通过电泳实验证明胶体带电 | |
| B. | 通常利用丁达尔效应区别溶液与胶体 | |
| C. | 过滤实验说明胶体粒子不能透过滤纸 | |
| D. | 向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体 |
16.现有①液态氧;②氢氧化铁胶体;③食盐水;④碳酸钠;⑤氢氧化钾;⑥空气,对上述物质的分类全部正确的是( )
| A. | 盐--③④ | B. | 纯净物--④⑤⑥ | C. | 碱--④⑤ | D. | 混合物--②③⑥ |
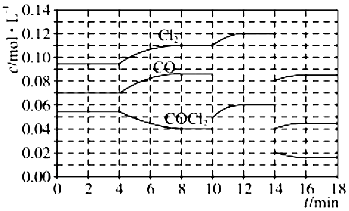 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.