题目内容
15. 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.(1)实验室中常用来制备氯气的离子方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(H)分别为-890.3kJmol-1、-285.8kJmol-1和-283.0kJmol-1,则生成1m3(标准状况)CO所需热量为5.52×103KJ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为CHCl3+H2O2═COCl2↑+HCl+H2O;
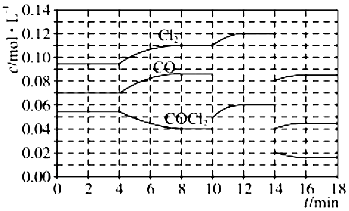
(4)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g) H=+108kJmol-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
①计算反应在第8min时的平衡常数K=0.234mol/L;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(8)>T(2)(填“<”“>”“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=0.031 mol•L-1
④比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小v(5~6)>v(2~3)=v(12~13);
⑤比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(15~16)<v(5~6)(填“<”“>”“=”),原因是在相同温度时,该反应的反应物浓度越高,反应速率越大.
分析 (1)实验室通常用二氧化锰与浓盐酸共热的方法制备氯气;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式,据此计算;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成;
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式K=$\frac{c(CO)c(C{l}_{2})}{c(COC{l}_{2})}$计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气与水制取氯气,反应方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ•mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ•mol -1,
即生成2molCO,需要吸热247.3 KJ,那么要得到1立方米的CO,吸热为$\frac{1000L}{22.4L/mol}$×$\frac{247.3KJ/mol}{2}$=5.52×103KJ;
故答案为:5.52×103KJ;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl3+H2O2═COCl2↑+HCl+H2O,
故答案为:CHCl3+H2O2═COCl2↑+HCl+H2O;
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=$\frac{c(CO)c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,
故答案为:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L;
故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),
故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:<;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评 本题考查化学平衡计算、化学平衡移动、平衡常数、浓度随时间变化曲线等,理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,是对学生综合能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2O和SO2 | B. | HCl和KCl | C. | Na2O2和 H2O2 | D. | NH4F和NaF |
I.已知:2NO(g)+O2(g)=2NO2(g)△H=b kJ•mol-1;CO的燃烧热为c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II.一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.已知常温下,该溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5).若向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{H}_{4}^{+})}{c(S{O}_{4}^{2-})}$的值将变大(填“变大”、“不变”或“变小”).
III.如图2所示,用无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下达到平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 任何纯净物都是有一种元素组成的 | |
| C. | 含有氧元素的化合物一定是氧化物 | |
| D. | 有不同种元素组成的纯净物是化合物 |
| A. | c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-) | B. | c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| A. | 0.6mol | B. | 0.9mol | ||
| C. | 大于0.4mol,小于0.6mol | D. | 大于0.6,小于0.9mol |
| A. | 相同质量、不同密度的N2O 和CO2 | |
| B. | 相同体积、相同密度的CO 和 C2 H4 | |
| C. | 相同温度、相同压强、相同体积的O2和O3 | |
| D. | 相同压强、相同质量的C2H4和C3H6 |