题目内容
18.元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,与扇形元素周期表的填充对应,并回答下列问题: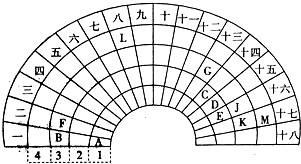
(1)E代表的元素处于常见周期表的位置是第二周期第VIA族.G的离子结构示意图
 .
.(2)DE2的电子式是
 ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程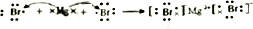 .
.(3)元素B和M形成的化合物的水溶液与元素KF的单质反应的离子方程式为:Cl2+2Br-=Br2+2Cl-.反应后,向溶液中加入CK4溶剂,振荡后现象为下层溶液呈橙红色.
(4)B、F、G三种元素最高价氧化物对应的水化物碱性最强的是NaOH(填化学式);比较元素J、K的非金属性强弱,J的非金属性弱于K(填“强”或“弱”).并用化学方程式证明上述结论Cl2+H2S=2HCl+S↑或Cl2+Na2S=2NaCl+S↓.
分析 由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E为O,G为Al,Al的离子核外有10个电子;
(2)DE2为CO2;FM2为MgBr2,为离子化合物;
(3)B和M形成的化合物为NaBr,与氯气反应生成溴,加四氯化碳发生萃取;
(4)同周期,从左向右金属性减弱,非金属性增强.
解答 解:由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E位于第二周期第VIA族,Al的离子结构示意图为 ,故答案为:第二周期第VIA族;
,故答案为:第二周期第VIA族; ;
;
(2)DE2为CO2,其电子式为 ;BM2为MgBr2,为离子化合物,用电子式表示形成过程为
;BM2为MgBr2,为离子化合物,用电子式表示形成过程为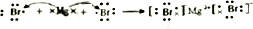 ,
,
故答案为: ;
;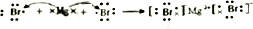 ;
;
(3)B和M形成的化合物为NaBr,与氯气反应生成溴,离子反应为Cl2+2Br-=Br2+2Cl-,加四氯化碳发生萃取,现象为下层溶液呈橙红色,
故答案为:Cl2+2Br-=Br2+2Cl-;下层溶液呈橙红色;
(4)同周期,从左向右金属性减弱,非金属性增强,则B、F、G三种元素最高价氧化物对应的水化物碱性最强的是NaOH;比较元素J、K的非金属性强弱,J的非金属性弱于K,并用化学方程式证明上述结论为Cl2+H2S=2HCl+S↑或 Cl2+Na2S=2NaCl+S↓,
故答案为:NaOH;弱;Cl2+H2S=2HCl+S↑或 Cl2+Na2S=2NaCl+S↓.
点评 本题考查元素的位置、结构与性质,为高频考点,把握短周期及扇形结构与现行周期表的对应关系推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的应用,综合性较强,题目难度不大.

练习册系列答案
相关题目
9.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
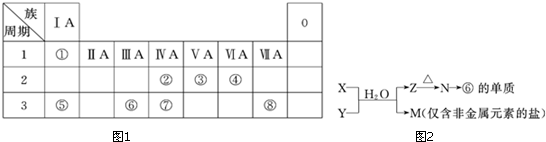
(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式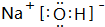 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生图2反应:
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.

(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
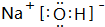 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
13.短周期主族元素W、R、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差1.下列叙述正确的是( )
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
8.在下列元素中,不属于主族元素的是( )
| A. | p | B. | Fe | C. | Ca | D. | I |
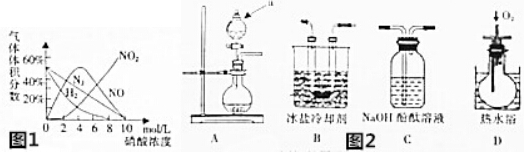
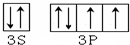 .
.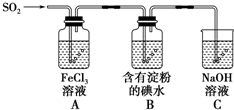 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示 回答下列问题:
回答下列问题: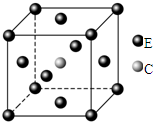 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题: