题目内容
20.分析以下反应:(1)在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,氧化剂是MnO2,发生氧化反应是HCl,生成1mol Cl2时转移电子数目为2mol,被氧化的HCl的物质的量是2mol,盐酸显示的性质是还原性和酸性.
(2)在反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,Cl2在反应中表现出的性质氧化剂、还原剂.每有3mol Cl2参与反应转移电子数目为5mol,氧化剂与还原剂物质的量之比为5:1.
分析 (1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,4molHCl反应其中只有2molHCl被氧化生成1molCl2,以此来解答;
(2)反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O中,Cl元素的化合价由0降低为-1价,由0升高为+5价,以此来解答.
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,4molHCl反应其中只有2molHCl被氧化生成1molCl2,氧化剂是二氧化锰,HCl发生氧化反应;生成1mol Cl2时转移电子数目为2mol,被氧化的HCl的物质的量是2mol,盐酸显示的性质是还原性和酸性,故答案为:MnO2;HCl;2mol;2mol;还原性和酸性;
(2)反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O中,因氯气中Cl元素的化合价既升高又降低,则Cl2既是氧化剂也是还原剂,氢氧化钠中各元素的化合价都不变,所以氢氧化钠既不是氧化剂又不是还原剂,3molCl2完全反应电子转移3mol×2×$\frac{5}{6}$(1-0)=5mol,氧化剂和还原剂的物质的量之比是5:1,故答案为:氧化剂、还原剂;5mol;5:1.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应中基本概念和电子转移的考查,题目难度不大.

练习册系列答案
相关题目
11.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | SiO2和SO2 | B. | NaCl和HCl | C. | CO2和H2O | D. | CH4和KCl |
15.开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
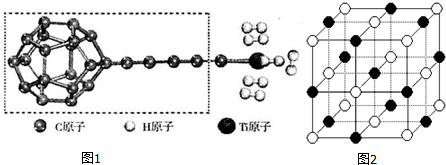
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
12.短周期元素A、B、C,原子序数依次递增.已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<C<B | |
| B. | 2.32g四氧化三铁与足量的B完全反应转移0.09mol电子 | |
| C. | C的气态氢化物无毒 | |
| D. | A元素在周期表中位于第二周期第VIA族 |
9.下列反应中,属于取代反应的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 将苯滴入溴水中,振荡后水层接近无色 | |
| D. | 乙烯使KMnO4溶液褪色 |

 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.
 .
.