题目内容
5.氧化还原反应及盐与酸或碱的复分解反应遵循“强制弱”的规律,个别反应不符合该规律.下列反应中属于个别反应的是( )| A. | 2Fe3++Cu=2Fe2++Cu 2+ | B. | Cu2++H2S=CuS↓+2H+ | ||
| C. | Cl2+2I-=2Cl-+I2 | D. | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,复分解反应中强酸制取弱酸、强碱制取弱碱,以此来解答.
解答 解:A.2Fe3++Cu=2Fe2++Cu 2+中氧化性为Fe3+>Cu 2+,符合“强制弱”的规律,故A不选;
B.Cu2++H2S=CuS↓+2H+中,弱酸制取强酸,不符合规律,为个别反应,故B选;
C.Cl2+2I-=2Cl-+I2中氧化性为Cl2>I2,符合“强制弱”的规律,故C不选;
D.Al3++3NH3•H2O=Al(OH)3↓+3NH4+中碱性NH3•H2O>Al(OH)3,符合“强制弱”的规律,故D不选;
故选B.
点评 本题考查反应的规律,为高频考点,把握氧化还原反应、复分解反应中的反应规律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
15. 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )| A. | 0.08mol•L-1•s-1 | B. | 0.30mol•L-1•s-1 | C. | 0.16mol•L-1•s-1 | D. | 0.32mol•L-1•s-1 |
16.下列物质在给定条件下能实现转化的是( )
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCI(aq)}{→}$SiCl4 | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Na$\stackrel{O_{2}/△}{→}$Na2O2$\stackrel{HI(aq)}{→}$NaI | |
| D. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu |
13.下列事实不能用勒夏特列原理解释的是( )
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
10. ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:
回答下列问题:
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
17.己知N2(g)+3H2(g)?2NH3(g)△H<0.图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
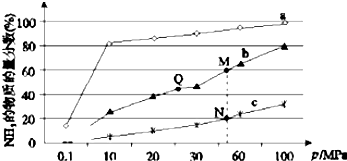
关于工业合成氨的反应,下列叙述不正确的是( )

关于工业合成氨的反应,下列叙述不正确的是( )
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
14.已知49%(溶质的质量分数)的硫酸溶液的浓度为amol•L-1,试判断98%硫酸溶液的浓度为( )
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
 +NaOH→
+NaOH→ +
+


 .
.