题目内容
11.近年来某市政府率先在公交车和出租车中推行用天然气代替汽油作燃料的改革,取得了显著进展.走上街头你会发现不少公交车和出租车上有“CNG”的标志,代表它们是以天然气作为燃气的汽车.(1)天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而生成的,因此天然气中所贮藏的化学能最终来自于太阳能.
(2)天然气的主要成分是甲烷.
(3)天然气的主要成分是一种很好的燃料.已知4g该主要成分完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则上述成分燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol.
分析 (1)天然气的能量来自于生物质能,而生物质能来自于太阳能;
(2)天然气的主要成分是甲烷;
(3)依据热化学方程式书写方法书写,标注物质聚集状态,计算对应化学方程式量下的焓变写出热化学方程式.
解答 解:(1)由于天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而生成的,即天然气的能量来自于生物质能,而生物质能来自于太阳能,故天然气的能量归根结底来自于太阳能,故答案为:太阳能;
(2)天然气的主要成分是甲烷,是一种无污染的绿色能源,故答案为:甲烷;
(3)4g甲烷即0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,1mol甲烷反应燃烧的反应热$\frac{222.5KJ}{0.25mol}$=890KJ/mol;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol.
点评 本题考查了能量的转化和热化学方程式的书写方法和计算应用,题目较简单.注意基础的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列有关实验的叙述,正确的是(填序号)( )
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 淀粉在稀硫酸催化作用下水解,向水解液中加入银氨溶液,加热出现银镜 | |
| C. | 用分液漏斗分离己烷和水的混合液体 | |
| D. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| E. | 配制银氨溶液时,向稀硝酸银溶液慢慢滴加稀氨水,直至产生沉淀恰好消失 | |
| F. | 在一定量CuSO4溶液中,加入少量NaOH溶液,振荡后加入葡萄糖溶液,加热至沸腾,出现砖红色沉淀 | |
| G. | 制取乙酸乙酯实验中,在一定量浓硫酸中,依次加入乙酸和乙醇后加热 | |
| H. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
6.下列化学用语表述不正确的是( )
| A. | 乙炔分子的结构简式:C2H2 | B. | CH4的球棍模型: | ||
| C. | S2-的结构示意图: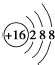 | D. | 乙烯的结构简式:CH2=CH2 |
3.“爱美之心人间有之”染发似乎已成为现代人生活中的一部分,但化学品的安全、合理使用是不容忽视的问题,下列染发剂对人体危害最小的是( )
| A. | 植物染发剂(如甲花叶、西洋甘菊花) | B. | 无机染发剂 | ||
| C. | 合成染发剂(如对苯二胺) | D. | 某些芳香胺类化合物 |
20.将质量为m g的铁片放入CuSO4溶液中,过一会儿取出干燥、称量,铁片质量变为n g,被氧化的铁片质量是( )
| A. | 8(m-n)g | B. | 8(n-m)g | C. | 7(n-m)g | D. | 7(m-n)g |
 ;
; .
.