题目内容
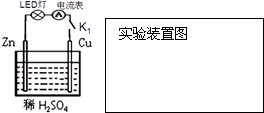 (1)原电池是一种将
(1)原电池是一种将(2)利用反应:Cu+2Ag+=2Ag+Cu2+设计一个化学电池(电极材料和电解液自选),画出实验装置图,注明电解质溶液名称、正负极材料和电子流向.
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极方程式(写离子方程式)为
(4)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH+H2O→CH3COOH+4H++4e-.正极的反应式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池是将化学能转变为电能的装置,图中的Cu、Zn原电池中,Zn失去电子作负极,被氧化,正极上氢离子得到电子生成氢气,有电流通过导线灯泡发光,电流表指针偏转;
(2)根据反应方程式中反应前后的金属单质确定电极材料,根据反应物中的化合物确定电解质;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子;
(4)酸性燃料电池中氧气在正极得电子生成水,根据正极和负极的电极反应式书写总反应.
(2)根据反应方程式中反应前后的金属单质确定电极材料,根据反应物中的化合物确定电解质;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子;
(4)酸性燃料电池中氧气在正极得电子生成水,根据正极和负极的电极反应式书写总反应.
解答:
解:(1)原电池是一种将化学能转变为电能的装置,图中的Cu、Zn原电池中,Zn失去电子作负极,被氧化,发生氧化反应,Cu作正极,正极上氢离子得到电子发生还原反应生成氢气,电极反应为2H++2e-=H2↑,有电流通过导线,所以观察到Zn电极逐渐溶解,正极上有无色气泡生成,灯泡发光,电流表指针偏转,
故答案为:化学;电;Zn电极逐渐溶解,Cu电极表面有气泡生成,LED灯发光,电流表指针偏转;还原;2H++2e-=H2↑.
(2)Cu+2Ag+=Cu2++2Ag,根据反应前后的金属单质确定电极材料,所以该原电池的电极材料是铜和银,铜比银易失去电子,所以铜作负极,银作正极;反应物中的化合物为含银离子的可溶性化合物,常见的有硝酸银,所以电解质溶液为硝酸银溶液;外电路中电子的流向为Cu→Ag,电流的流向为Ag→Cu,该原电池的装置图为: ;
;
故答案为: ;
;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子,则其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)酸性燃料电池中氧气在正极得电子生成水,其电极反应式为:O2+4H++4e-=2H2O,正极的电极反应式与和负极的电极反应式相加即是总反应,所以电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O,
故答案为:O2+4H++4e-=2H2O;CH3CH2OH+O2=CH3COOH+H2O.
故答案为:化学;电;Zn电极逐渐溶解,Cu电极表面有气泡生成,LED灯发光,电流表指针偏转;还原;2H++2e-=H2↑.
(2)Cu+2Ag+=Cu2++2Ag,根据反应前后的金属单质确定电极材料,所以该原电池的电极材料是铜和银,铜比银易失去电子,所以铜作负极,银作正极;反应物中的化合物为含银离子的可溶性化合物,常见的有硝酸银,所以电解质溶液为硝酸银溶液;外电路中电子的流向为Cu→Ag,电流的流向为Ag→Cu,该原电池的装置图为:
 ;
;故答案为:
 ;
;(3)碱性条件下,负极上甲醇失电子生成碳酸根离子,则其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)酸性燃料电池中氧气在正极得电子生成水,其电极反应式为:O2+4H++4e-=2H2O,正极的电极反应式与和负极的电极反应式相加即是总反应,所以电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O,
故答案为:O2+4H++4e-=2H2O;CH3CH2OH+O2=CH3COOH+H2O.
点评:本题考查原电池的工作原理,题目难度中等,注意把握电极方程式的书写,特别是电解质溶液的酸碱性对电极方程式的影响.

练习册系列答案
相关题目
下列各组物质的分离可用分液漏斗的是( )
| A、乙醇和水 |
| B、苯和食盐水 |
| C、黄河水中的泥沙与水 |
| D、食盐水中获得食盐 |
已知反应X+Y=M+N为吸热反应,对该反应的下列说法中正确的是( )
| A、X的能量一定低于M的能量 |
| B、Y的能量一定低于N的能量 |
| C、因该反应为吸热反应,故该反应一定要加热才可发生 |
| D、X和Y的总能量一定低于M和N的总能量 |
1molCH4与一定量的氯气在光照条件下发生取代反应,若产生的四种取代物的物质的量相等,则反应生成HCl的物质的量为( )
| A、1.25mol |
| B、2mol |
| C、2.5mol |
| D、4mol |
下列说法中正确的是( )
| A、质量相等状态不同的同种物质,它们的焓相等 |
| B、当反应放热时,△H>0,反应吸热时,△H<0 |
| C、在一个确定的化学反应关系中,反应物的总焓与反应产物的总焓一定不同 |
| D、焓变是指1 mol物质参加反应时的能量变化 |