题目内容
1.下列各项的叙述中都包含两个数值,前一数值大于后一数值的是( )| A. | 干冰中的分子间作用力和单质碘中的分子间作用力 | |
| B. | CsCl晶体中与一个Cl-紧邻的Cs+数和NaCl晶体中与一个Cl-紧邻的Na+数 | |
| C. | 晶体硅中Si-Si键的键能和金刚石中C-C键的键能 | |
| D. | 水分子中O-H键的键角和甲烷分子中C-H键的键角 |
分析 A.分子晶体的分子间作用力越大熔沸点越高;
B.根据NaCl的晶胞和CsCl的晶胞分析;
C.原子晶体中原子半径越小,共价键越强,键能越大;
D.根据水和甲烷的空间结构分析.
解答 解:A.分子晶体的分子间作用力越大熔沸点越高,已知常温下碘为固体,干冰为气体,所以碘的熔沸点高,即碘的分子间作用力大,故A错误;
B.NaCl的晶胞中一个Cl-紧邻的Na+数为6,而CsCl的晶胞中与一个Cl-紧邻的Cs+数目为8,故B正确;
C.原子晶体中原子半径越小,共价键越强,键能越大,已知碳原子半径小于硅原子半径,所以晶体硅中Si-Si键的键能小于金刚石中C-C键的键能,故C错误;
D.水为V形,O-H键的键角为104.5°,甲烷的正四面体结构,分子中C-H键的键角为109•28′,故D错误.
故选B.
点评 本题考查较为综合,涉及分子间作用力、离子晶体的配位数、原子晶体中键能的比较、分子的键角,考查的知识点较多,属于基础知识的考查,难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
12.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
9.下列化学用语使用正确的是( )
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
16.中和一定量的某醋酸溶液时,消耗氢氧化钠m g,如果先向该醋酸溶液中加入少量的醋,然后再用氢氧化钠中和,此时可消耗氢氧化钠n g,则m与n的关系为( )
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
13.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
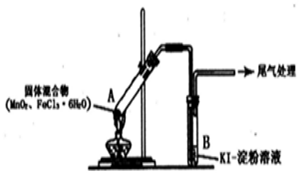
实验操作和现象如表:
回答下列问题:
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.

实验操作和现象如表:
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.
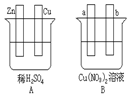 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空: