题目内容
15.常温下 0.1 mol•L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三者中所占物质的量分数(a)随pH变化的关系如图所示.下列表述正确的是( )
| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
分析 A.亚硫酸为二元弱酸,其电离分步进行;结合图象计算亚硫酸的Ka1;
B.根据亚硫酸溶液中的电荷守恒进行分析;
C.根据图象数据可知,pH=2.5时:c(HSO3-)>c(H2SO3);
D.pH=8.5时,亚硫酸氢根离子的浓度为0,所以通入氯气后其浓度不会变化.
解答 解:A.亚硫酸的第一步电离方程式为:H2SO3?H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=$\frac{0.24×1}{0.9}$≈0.27,故A错误;
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2•c(SO32-)+c(OH-),在该等式两边同时乘以氢离子浓度可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C.在pH=2.5该溶液中,根据图象曲线可知各离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故C错误;
D.向pH为8.5的上述体系中通入极少量Cl2的过程中,亚硫酸根离子浓度减小,而亚硫酸氢根离子浓度基本不变,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体.在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能.据此判断在100kPa压强下,下列说法正确的是( )
| A. | 金刚石比石墨更稳定 | |
| B. | 石墨比金刚石更稳定 | |
| C. | 1 mol金刚石比1 mol石墨的总能量低 | |
| D. | 1 mol金刚石转变为石墨需要吸收1.895 kJ能量 |
3.在容积固定的密闭容器中通入各为1mol的A、C、D和n mol B,发生如下反应A(g)+4B(g)?C(g)+2D(g).当n在一定范围内变化时,均可通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol,若使起始反应向正反应方向进行,则n的取值范围是( )
| A. | 1<n<2 | B. | 1<n<5 | C. | 2<n<4 | D. | 2<n<5 |
20.某有机物结构如下:CH3-CH=CH-Cl,该有机物能发生:①取代反应 ②加成反应 ③聚合反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥AgNO3溶液生成白色沉淀( )
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
7.某市大气质量监测站对市区出现雾霾时的大气监测发现:首先要污染物为PM2.5,并对其进行分析.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
根据表中数据计算该试样的pH=5.
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:
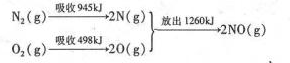
①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:

①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
4.乙酸的某种同系物Q存在同类型的同分异构体下列,有关Q的说法中正确的是( )
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
5.6.4g铜与过量硝酸(8mol/L,50mL)充分反应,硝酸的还原产物为NO和NO2,反应后溶液中含有H+ 0.05mol.(假定反应前后溶液体积不变),下列说法不正确的是( )
| A. | NO与NO2的物质的量之比为1:5 | |
| B. | 反应后溶液中所含NO3-的物质的量浓度为0.5 mol/L | |
| C. | 被还原的硝酸的物质的量为0.15 mol | |
| D. | 上述过程转移电子总的物质的量为0.2 mol |
 ,
, .
. ,
, (或
(或 ).
).