题目内容
4.乙酸的某种同系物Q存在同类型的同分异构体下列,有关Q的说法中正确的是( )| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
分析 A.Q存在同类型的同分异构体说明为可至少含有4个碳原子的羧酸;
B.羧酸和相同碳原子书的酯类属于同分异构体;
C.同系物是分子组成上相差整数个-CH2-结构,具有相同的通式的同一类有机物的互称;
D.根根据质量守恒定律可以知道,反应前后元素的质量不变,所以可以根据化学反应前后碳元素和氢元素的质量相等来计算即:二氧化碳的质量乘以二氧化碳中碳元素的质量分数,再除以碳元素的相对原子质量,就可以得到二氧化碳中碳原子的个数,同样可以得到水中氢原子的个数;两者相比得到碳原子和氢原子的个数比,根据质量守恒定律可知这个比就是该有机物中碳、氢元素的原子个数比,并作出判断即可.
解答 解:A.Q存在同类型的同分异构体说明为可至少含有4个碳原子的羧酸,不可能为C3H6O2,故A错误;
B.羧酸存在属于酯类的同分异构体,故B错误;
C.同系物是分子组成上相差整数个-CH2-结构,相对分子质量比乙酸大14n,故C正确;
D.根据二氧化碳和水的质量比为11:9,所以可以求算出碳元素和氢元素的质量比为:可计算出碳、氢两种元素的质量比为:(11×$\frac{12}{44}$×100%):(9×$\frac{2}{18}$×100%)=3:1,羧酸的通式为CnH2nO2,故D错误.
故选C.
点评 本题考查了同系物、同分异构体等,题目难度不大,要求学生具有整合知识的能力,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
9.NH4NO3在通常条件下加热分解方式有多种,一般不出下列范围,根据已学知识判断,下列反应不可能的是( )
| A. | NH4NO3→N2+O2+H2O | B. | NH4NO3→NH3+HNO3 | ||
| C. | NH4NO3→O2+HNO3+H2O | D. | NH4NO3→N2+HNO3+H2O |
15.常温下 0.1 mol•L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三者中所占物质的量分数(a)随pH变化的关系如图所示.下列表述正确的是( )


| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
19.下列叙述中,正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 在周期表主族元素的最外层电子数等于其主族序数 | |
| D. | 元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素 |
13.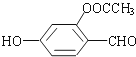 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
14.下列过程一定发生化学变化的是( )
| A. | 萝卜风干 | B. | 苹果冷藏 | C. | 葡萄酿酒 | D. | 甘蔗榨汁 |
 .
.
 、
、 (写2种).
(写2种).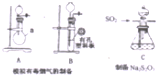 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题: