题目内容
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )


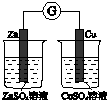
| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B、C、D装置中pH均变大. |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:当K闭合时,B装置能自发进行氧化还原反应,所以为原电池,则A、C、D都是电解池,B中Zn易失电子作负极、Cu作正极,所以A中C、C中Cu、D中粗铜都是阳极,A中Fe、C中Ag、D中纯铜都是阴极;
当K打开时,B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀,据此分析解答.
当K打开时,B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀,据此分析解答.
解答:
解:当K闭合时,B装置能自发进行氧化还原反应,所以为原电池,则A、C、D都是电解池,B中Zn易失电子作负极、Cu作正极,所以A中C、C中Cu、D中粗铜都是阳极,A中Fe、C中Ag、D中纯铜都是阴极;
当K打开时,B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀,
A.当K闭合时,B装置能自发进行氧化还原反应,为原电池,在电路中作电源,A为电解池,故A错误;
B.当K断开时,B装置不能构成原电池,锌片和稀硫酸发生化学腐蚀而溶解,有氢气产生,故B正确;
C.当K闭合后,B为原电池,A、C、D为电解池,电子从负极流向阴极,再从阴极流向阳极,所以整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②,电子不进入电解质溶液,故C正确;
D.当K闭合后,C装置属于电镀池,该装置中pH不变,故D错误;
故选AD.
当K打开时,B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀,
A.当K闭合时,B装置能自发进行氧化还原反应,为原电池,在电路中作电源,A为电解池,故A错误;
B.当K断开时,B装置不能构成原电池,锌片和稀硫酸发生化学腐蚀而溶解,有氢气产生,故B正确;
C.当K闭合后,B为原电池,A、C、D为电解池,电子从负极流向阴极,再从阴极流向阳极,所以整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②,电子不进入电解质溶液,故C正确;
D.当K闭合后,C装置属于电镀池,该装置中pH不变,故D错误;
故选AD.
点评:本题考查原电池和电解池原理,根据反应的自发性确定原电池,知道各个电极发生的反应,注意:电子不进入电解质溶液,电解质溶液是通过阴阳离子定向移动形成电流,为易错点.

练习册系列答案
相关题目
 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如下图所示.下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如下图所示.下列说法不正确的是( )| A、0~10 min 内υ(H2)=0.3 mol/(L?min) | ||
B、T℃时,平衡常数K=
| ||
| C、T℃时,若上述反应中有64 g CH3OH生成,则同时放出98.0 kJ的热量 | ||
| D、达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )
将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )| A、O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| B、O到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3- |
| C、通入CO2气体的体积在标准状况下为44.8L |
| D、NaOH溶液的物质的量浓度为5mol?L-1 |
在25℃时,密闭容器中X、Y、Z三种气体的浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、反应可表示为X+3Y?2Z,平衡常数为1600 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |