题目内容
氮元素的化合物种类繁多,性质也各不相同.
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g)?N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
则平衡时氨气的转化率为 .
(3)NH4+ 在溶液中能发生水解反应.在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5mol/L,则在该温度下此溶液中氨水的电离平衡常教Kb(NH3?H2O)= .
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g)?N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据如下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
(3)NH4+ 在溶液中能发生水解反应.在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5mol/L,则在该温度下此溶液中氨水的电离平衡常教Kb(NH3?H2O)=
考点:化学平衡的计算,热化学方程式,弱电解质在水溶液中的电离平衡
专题:
分析:(1)根据图示写出两个热化学方程式,根据盖斯定律将两个反应相加或相减以得到NO2(g)与SO2(g)生成SO3(g)和NO(g)的反应热,再书写热化学反应方程式;
(2)根据数据判断4分钟达到平衡,利用压强之比等于物质的量之比计算;
(3)写出氨水电离方程式,计算出离子浓度,代入电离平衡常数表达式计算氨水的电离平衡常数.
(2)根据数据判断4分钟达到平衡,利用压强之比等于物质的量之比计算;
(3)写出氨水电离方程式,计算出离子浓度,代入电离平衡常数表达式计算氨水的电离平衡常数.
解答:
解:(1)由图示得到以下两个方程式:
①2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,
②2NO(g)+O2(g) 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,
根据盖斯定律可知,
可得NO2(g)+SO2(g)═SO3(g)+NO(g),
则△H=
=-41.8kJ?mol-1,
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(2)根据数据判断4分钟达到平衡,设氨气的转化率为a,利用压强之比等于物质的量之比计算;
2NH3 ?N2 +3 H2 △n
2 1 3 2
a 0.5a 1.5a a
=
,解得a=0.4,故氨气的转化率为40%,故答案为:40%;
(3)NH4+在溶液中能发生水解反应,NH4++H2O?NH3?H2O+H+
故c(NH3?H2O)=c(H+)=1×10-5mol/L,则c(OH-)=
=
=10-9mol/L,c(NH4+)=0.1mol/L,
氨水的电离方程式为:NH3?H2O?NH4++OH-
电离平衡常数Kb(NH3?H2O)=
,
把以上数据代入平衡常数表达式:Kb(NH3?H2O)=
=1×10-5mol/L,
故答案为:1×10-5mol/L.
①2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,②2NO(g)+O2(g)
 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,根据盖斯定律可知,
| ①-② |
| 2 |
则△H=
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(2)根据数据判断4分钟达到平衡,设氨气的转化率为a,利用压强之比等于物质的量之比计算;
2NH3 ?N2 +3 H2 △n
2 1 3 2
a 0.5a 1.5a a
| 5 |
| 7 |
| 1 |
| 1+a |
(3)NH4+在溶液中能发生水解反应,NH4++H2O?NH3?H2O+H+
故c(NH3?H2O)=c(H+)=1×10-5mol/L,则c(OH-)=
| Kw |
| c(H+) |
| 10-14 |
| 10-5 |
氨水的电离方程式为:NH3?H2O?NH4++OH-
电离平衡常数Kb(NH3?H2O)=
c(N
| ||
| c(NH3?H2O) |
把以上数据代入平衡常数表达式:Kb(NH3?H2O)=
| 0.1mol/L×10-9mol/L |
| 10-5mol/L |
故答案为:1×10-5mol/L.
点评:本题考查了热化学方程式的书写,平衡转化率的计算,电离方程式的书写及电离平衡常数的计算,其中电离平衡常数计算较难,答题时注意化学原理的基础知识的灵活运用.

练习册系列答案
相关题目
某二价阴离子R2-有36个电子,其质量数为79,则核内的中子数是( )
| A、39 | B、41 | C、43 | D、45 |
下列实验中,不能达到预期目的是( )
| A、向某未知溶液中滴加足量稀盐酸,再加几滴BaCl2溶液,检验SO42-的存在 |
| B、用100mL量筒量取20.00mL Na2CO3溶液 |
| C、不用另加任何试剂就能鉴别HCl、Na2CO3、Na2SO4 和BaCl2四种无色溶液 |
| D、用粥汤检验淀粉溶液具有丁达尔效应 |
有4种混合溶液,分别由等体积0.1mol?L-1的2种溶液混合而成:①CH3COONa与NaCl;②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)排序正确的是( )
| A、②>④>③>① |
| B、②>④>①>③ |
| C、③>①>②>④ |
| D、①>④>③>② |
用惰性电极实现电解,下列说法正确的是( )
| A、电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| B、电解CuSO4溶液一段时间后,再加入一定质量Cu(OH)2,溶液能与原溶液完全一样 |
| C、电解硫酸钠溶液时,Na+向阳极移动 |
| D、电解KOH溶液,实质上是电解水,故溶液pH不变 |
在一定的温度下,浓度都是3mol/L的两种气体A2和B2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别是c(A2)=1.2mol/L,c(B2)=2.4mol/L,c(Z)=1.2mol/L.则该反应的反应式可以表示为( )
| A、A2+2B2=2AB2 |
| B、2A2+B2=2A2B |
| C、3A2+B2=2A3B |
| D、A2+3B2=2AB3 |
某烃的结构简式为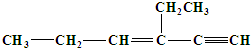 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
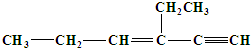 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )| A、4、4、5 |
| B、2、5、4 |
| C、4、3、6 |
| D、4、6、4 |
 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问: