题目内容
有4种混合溶液,分别由等体积0.1mol?L-1的2种溶液混合而成:①CH3COONa与NaCl;②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)排序正确的是( )
| A、②>④>③>① |
| B、②>④>①>③ |
| C、③>①>②>④ |
| D、①>④>③>② |
考点:离子浓度大小的比较
专题:
分析:①CH3COONa与NaCl,醋酸根离子发生水解;②CH3COONa与NaOH,氢氧化钠电离的氢氧根离子抑制了醋酸根离子的水解;③CH3COONa与NaHSO4,二者恰好反应生成醋酸,醋酸的电离程度较小,溶液中醋酸根离子浓度最小;④CH3COONa与NaHCO3,碳酸氢根离子水解后的溶液显示碱性,抑制了醋酸根离子的水解,抑制程度小于②,据此进行判断各混合液中醋酸根离子浓度大小.
解答:
解:①CH3COONa与NaCl,醋酸根离子发生水解;
②CH3COONa与NaOH,氢氧化钠为强碱,氢氧化钠电离的氢氧根离子大大抑制了醋酸根离子的水解,醋酸根离子浓度最大;
③CH3COONa与NaHSO4,二者恰好反应生成醋酸,醋酸的电离程度较小,溶液中醋酸根离子浓度最小;
④CH3COONa与NaHCO3,碳酸氢根离子水解后的溶液显示碱性,抑制了醋酸根离子的水解,但抑制程度小于②,醋酸根离子浓度大于①、小于②;
根据以上分析可知,各混合液中c(CH3COO-)浓度大小顺序为:②>④>①>③,
故选B.
②CH3COONa与NaOH,氢氧化钠为强碱,氢氧化钠电离的氢氧根离子大大抑制了醋酸根离子的水解,醋酸根离子浓度最大;
③CH3COONa与NaHSO4,二者恰好反应生成醋酸,醋酸的电离程度较小,溶液中醋酸根离子浓度最小;
④CH3COONa与NaHCO3,碳酸氢根离子水解后的溶液显示碱性,抑制了醋酸根离子的水解,但抑制程度小于②,醋酸根离子浓度大于①、小于②;
根据以上分析可知,各混合液中c(CH3COO-)浓度大小顺序为:②>④>①>③,
故选B.
点评:本题考查了离子浓度大小比较,侧重考查盐的水解原理及其影响因素,题目难度中等,明确盐的水解的影响因素为解答关键,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
常温常压下,一种气态烷烃与一种气态烯烃的混和物共2升,完全燃烧后,恢复到原状况,得到2.4升二氧化碳.则该混和气体中一定含有( )
| A、甲烷 | B、乙烯 | C、乙烷 | D、丙烯 |
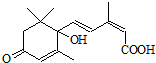 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
下列从海水中提取镁正确的方法是( )(提示:熔点:MgO2 850℃MgCl2 714℃)
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
下列说法正确的是( )
| A、在新制的氯水中加入NaOH溶液至中性时,满足c(Na+)=c(ClO-)+c(HClO) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,水解平衡常数Kh增大,而Kw不变 |
| C、常温下,pH=11的某碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合,则:2c(H+)-2c(OH)=C(CH3COO)-C(CH3COOH) |
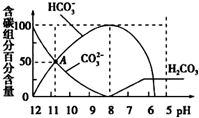 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、当加入20 mL盐酸时,混合溶液的pH约为8 |
下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
| A、2A(l)+B (l)═2C(g)△H1 |
| B、2A(g)+B (g)═2C(g)△H2 |
| C、2A(g)+B ( g )═2C(l)△H3 |
| D、2A(l)+B (l)═2C(l)△H4 |