题目内容
7.在厦参加国际磷化学会议的科学家认为无磷洗涤剂洗涤效果差,污染更严重,建议在建立磷回收机制后,重新使用加有磷化合物的含磷洗涤剂.对此的下列说法不正确 的是( )| A. | 含磷洗涤剂含有磷元素 | |
| B. | 只要解决污染问题,可能重新使用含磷洗涤剂 | |
| C. | 含磷洗涤剂含有磷单质 | |
| D. | 研究高效无污染的洗涤剂仍是化学家的任务 |
分析 A、通常含磷洗涤剂中含有三聚磷酸钠,三聚磷酸钠的化学式为Na5P3O10;
B、不使用含磷洗涤剂是因为磷的污染问题;
C、含磷洗涤剂中含有的是磷元素;
D、研究高效无污染的洗涤剂仍是目前的重要任务.
解答 解:A、通常含磷洗涤剂中含有三聚磷酸钠,含磷洗涤剂含有磷元素,故A正确;
B、不使用含磷洗涤剂是因为磷的污染会引起水体富营养化,只要解决污染问题,可能重新使用含磷洗涤剂,故B正确;
C、含磷洗涤剂含有磷元素,而不是含有磷单质,故C错误;
D、要无污染又高效的洗涤剂是所有人的愿望,研究高效无污染的洗涤剂仍是化学家的任务,故D正确.
故选C.
点评 本题考查了三废处理与环境保护的分析判断,现代社会化学与生活的联系越来越密切,解决化学产品与污染之间的问题是科学家的重要任务,注意知识的积累,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.有一支盛有溶液的50ml滴定管,其液面恰好在10.00ml,现把滴定管里的溶液全部排出,用量筒承接,量筒内溶液的体积为( )
| A. | 大于40.00ml | B. | 40.00ml | C. | 大于10.00ml | D. | 10.00ml |
18.维生素A的结构简式如图所示,关于它的叙述中正确的是( )
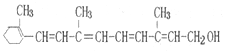
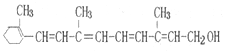
| A. | 维生素A分子式为C18H24O | |
| B. | 维生素A不能使溴的四氯化碳溶液褪色 | |
| C. | 维生素A不能与金属钠反应产生氢气 | |
| D. | 维生素A能发生氧化、加成、酯化反应 |
15.下列有关叙述正确的是( )
| A. | 用浓硝酸可以鉴别毛织物和棉织物 | |
| B. | 葡萄糖和蔗糖不是同分异构体,但是同系物 | |
| C. | 羊毛完全燃烧只生成CO2和H2O | |
| D. | 某学生设计了如图实验方案用以检验淀粉水解的情况: 由以上实验可以得出淀粉已完全水解 |
12.如表数据是在某温度下,金属镁和镍(Ni)分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
注:a和b均为与温度有关的常数,nm表示“纳米”
请回答:
Mg与Ni比较,哪一种更易氧化?Mg,其理由是氧化镁厚度增加的速度比氧化镍快.如果用Y表示氧化镁膜层厚,用t表示形成氧化薄膜层厚所需时间,Y和t的关系为Y=0.05at,Y=$\sqrt{t}$b.
| 反应时间/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚/nm | 0.05a | 0.2a | 0.45a | 0.8a | 1.25a |
| NiO层厚/nm | b | 2b | 3b | 4b | 5b |
请回答:
Mg与Ni比较,哪一种更易氧化?Mg,其理由是氧化镁厚度增加的速度比氧化镍快.如果用Y表示氧化镁膜层厚,用t表示形成氧化薄膜层厚所需时间,Y和t的关系为Y=0.05at,Y=$\sqrt{t}$b.
16.镁条在空气中燃烧后,其生成的产物可能含有的物质是( )
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
10.FeCl2是一种常用的还原剂.有关数据如下:
实验室可以用多种方法来制备无水FeCl2.回答下列问题:
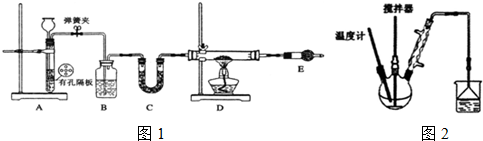
I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
| 相对式量 | 112.5 | 147 | 162.5 | 128 |

I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).



