题目内容
2.下列反应中,NH3即显还原性,又显碱性的是( )| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2 $\frac{\underline{\;\;△\;\;}}{\;}$ 4NO+6H2O | ||
| C. | 3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O | D. | 8NH3+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$ 6NH4Cl+N2 |
分析 还原性是指元素化合价上升,碱性是指能跟酸性物质反应.NH3中N的化合价为-3价,H的化合价为+1价,说明氨气具有还原性,只能是NH3中-3价的N化合价上升,说明氨气具有碱性,是指NH3能跟酸性物质反应.
解答 解:A.NH3+HCl═NH4Cl,反应前后化合价未变,该反应不是氧化还原反应,不合题意,故A错误;
B.反应4NH3+5O2 $\frac{\underline{\;\;△\;\;}}{\;}$ 4NO+6H2O中氨气中氮元素化合价升高表现为还原性,无碱性表现,故B错误;
C.3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O中NH3-3价的N被CuO氧化,氧化产物为N2,N2化合价为0价,氨气具有还原性.不表现为碱性氧,故C错误;
D.8NH3+3Cl2═6NH4Cl+N2为化还原反应,NH3中-3价的N被Cl2氧化,氧化产物为N2,NH3跟酸性气体HCl物质反应,为非氧化还原反应显示了氨气的碱性,故D正确,
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的相关性质,注重相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列关于元素周期表结构说法正确的是( )
| A. | 元素周期表中金属元素与非金属元素交界线附近的元素既具有一定的金属性也具有一定的非金属性,所以它们属于过渡元素 | |
| B. | 若M2+和N2-的核外电子层结构相同,则原子序数:N>M | |
| C. | 元素周期表的短周期元素中,最外层电子数是其电子层数2倍的元素共有4种 | |
| D. | 在元素周期表中,原子序数差值为2的两种元素有可能处于同一主族 |
4.某课外小组的同学设计了以下装置(部分夹持仪器已略)制取无水AlCl3(易升华),其中不能达到相应实验目的是( )
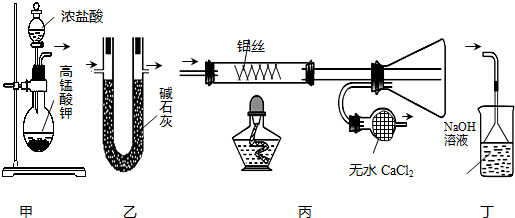

| A. | 用装置甲制取氯气 | B. | 用装置乙干燥氯气 | ||
| C. | 用装置丙制取并收集AlCl3 | D. | 用装置丁处理丙中排出的尾气 |
1.用铝灰(冶铝废弃物)为原料可制取超细α-氧化铝.铝灰的主要成分是Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如图:
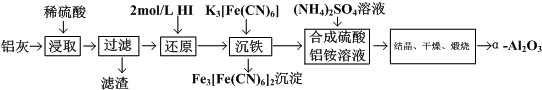
下列说法正确的是( )

下列说法正确的是( )
| A. | 加热搅拌可以提高铝灰的浸取率 | |
| B. | 流程中的HI,可以用H2O2代替 | |
| C. | 流程中的K3[Fe(CN)6],可以用NaOH溶液代替 | |
| D. | 流程中的得到硫酸铝按晶体的具体方法为:蒸发结晶、趁热过滤、洗涤、干燥 |
8.下列分离与提纯的方法不正确的是( )
| A. | 用蒸发、冷却结晶和过滤的方法从氯化钠和硝酸钾的混合溶液中离出硝酸钾 | |
| B. | 用分液的方法分离乙酸乙酯的饱和碳酸钠溶液 | |
| C. | 用加热的方法提纯含有少量碳酸氢钠的碳酸钠 | |
| D. | 用加水溶解、过滤的方法提含有硫酸钠的碳酸钙 |
7.下列说法正确的是( )
| A. | 常温常压下,11.2L氧气含氧分子数约为3.01×1023个 | |
| B. | 两个体积相同的容器,一个盛有NO,另一个盛有N2和O2的混合气体,在同温同压下两容器内气体分子总数、原子总数和气体质量也一定相等 | |
| C. | 标况下,等质量的O2和O3中所含的氧原子数目相等 | |
| D. | 将98gH2SO4溶于500ml水,得到溶液的物质的量浓度为2.0mol/L |
14.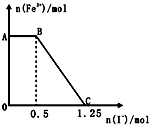 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A. | 图中AB段主要是高锰酸钾和碘化钾溶液反应 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | |
| D. | 向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
11.能正确表示下列反应的离子方程式( )
| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O | |
| B. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++O3-═3Fe3++NO↑+2H2O | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 常温下,浓硝酸与铁屑混合:2Fe+6H+═2Fe3++3H2↑ |
12.100mL 6mol•L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(固体) | B. | 氨水 | C. | 碳酸氢钠溶液 | D. | 水 |