题目内容
12.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1L 0.1 mol•L-1Na2CO3溶液中含有0.1NACO32- | |
| B. | 4.2gN3-中含有的电子数为2.4NA | |
| C. | 6.4gCu与足量浓硝酸反应,一定转移0.2 NA个电子 | |
| D. | 常温常压下,22.4L H2O中共用电子对数为2NA |
分析 A.碳酸钠溶液中碳酸根离子分步水解;
B.n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,1个N3-中含有的电子数22个;
C.铜物质的量.n=$\frac{m}{M}$=$\frac{6.4g}{64g/mol}$=0.1mol,铜全部反应,依据反应的铜计算电子转移数;
D.,22.4L H2O物质的量不是1mol;
解答 解:A.碳酸钠溶液中碳酸根离子分步水解,1L 0.1 mol•L-1Na2CO3溶液中含有CO32<0.1NA,故A错误;
B.4.2gN3-物质的量n=$\frac{m}{M}$=$\frac{4.2g}{42g/mol}$=0.1mol,1个N3-中含有的电子数22个,则0.1molN3-中含有的电子数2.2NA,故B错误;
C.铜物质的量.n=$\frac{m}{M}$=$\frac{6.4g}{64g/mol}$=0.1mol,铜全部反应,依据反应的铜计算电子转移数一定转移0.2 NA个电子,故C正确;
D.水为液体,22.4L H2O物质的量不是1mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用主要是质量换算物质的量计算微粒数,注意气体摩尔体积的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
3.短周期元素X、Y、Z三种原子原子序数之和为25,且Z、Y原子序数之和是X的原子序数2倍还多1.已知它们可形成化合物Y2X和ZX2,Y2X溶于水可与ZX2反应生成一种化合物Y2ZX3,下列有关分析不正确的是( )
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
20.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
请按要求回答下列问题:
(1)Y的原子结构示意图为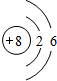 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为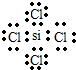 .
.
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
| Y | ||||
| Q | W | X | Z |
(1)Y的原子结构示意图为
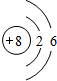 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为
 .
.(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
7. 如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
 如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )| A. | 放电过程,甲池发生氧化反应 | |
| B. | 放电过程,电池反应:2S22-+Br3-=S42-+3Br- | |
| C. | 充电过程,乙池为阳极室 | |
| D. | 充电过程,当阳极室阴离子增加了2mol,整个电路中电子转移2mol |
4.下列说法错误的是( )
| A. | 制造普通玻璃的原料是纯碱、石灰石和石英 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 二氧化硫有漂白性,可以使蓝色石蕊试纸褪色 | |
| D. | 漂白精、臭氧和活性炭都能用于游泳池的消毒 |
2.有机化合物Y可以由X合成: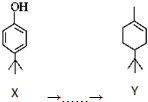 ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
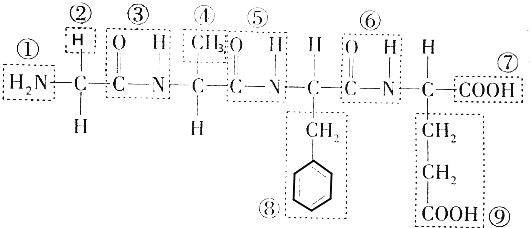
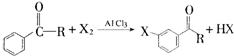
 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、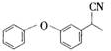 .
.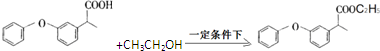 .
.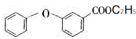 .
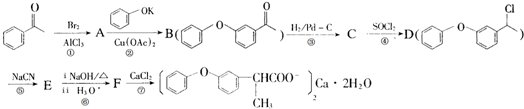
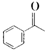
.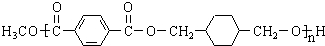 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.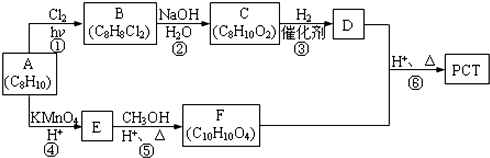
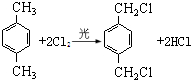 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.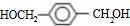 ,反应③的类型是加成反应,
,反应③的类型是加成反应,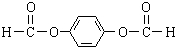 (写结构简式).
(写结构简式).