题目内容
某氯碱厂采用离子膜法电解饱和食盐水生产烧碱,其原理示意图如下.请结合示意图回答以下问题:
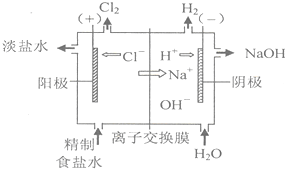
①写出电解饱和食盐水的化学方程式 .
②使用离子交换膜把电解槽分隔 成阴极室和阳极室的目的是 .
③该电解过程中可循环使用的物质是 (填“淡盐水”或“NaOH”)
④精制前的食盐水中含有较多的Ca2+、Mg2+、SO42-等杂质离子,需要加入试剂使杂质离子沉淀后,再通过 操作除去.

①写出电解饱和食盐水的化学方程式
②使用离子交换膜把电解槽分隔 成阴极室和阳极室的目的是
③该电解过程中可循环使用的物质是
④精制前的食盐水中含有较多的Ca2+、Mg2+、SO42-等杂质离子,需要加入试剂使杂质离子沉淀后,再通过
考点:电解原理
专题:电化学专题
分析:阳离子交换膜法电极饱和食盐水,依据钠离子移动方向可知出氯气的为阳极,出氢气的为阴极,结合电解原理判断两极的产物,出氯气为阳极,溶液中的阴离子氯离子失电子生成氯气,出氢气的为阴极,溶液中阳离子得到电子发生还原反应生成氢气;
①出氯气的为阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑;出氢气的为阴极,溶液中阳离子得到电子发生还原反应生成氢气,电极反应为2H++2e-=H2↑;据此写出反应化学方程式;
②使用阳离子交换膜,生成的氯气在阳极,生产的氢氧化钠在阴极,可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量;
③依据装置图分析循环使用是参与反应,反应过程又生成的物质;
④精制食盐除杂,加入试剂沉淀后过滤除去;
①出氯气的为阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑;出氢气的为阴极,溶液中阳离子得到电子发生还原反应生成氢气,电极反应为2H++2e-=H2↑;据此写出反应化学方程式;
②使用阳离子交换膜,生成的氯气在阳极,生产的氢氧化钠在阴极,可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量;
③依据装置图分析循环使用是参与反应,反应过程又生成的物质;
④精制食盐除杂,加入试剂沉淀后过滤除去;
解答:
解:①出氯气的电极为阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑;出氢气的电极为阴极,溶液中阳离子得到电子发生还原反应生成氢气,电极反应为2H++2e-=H2↑;电解饱和食盐水的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
②使用离子交换膜把电解槽分隔成阴极室和阳极室的目的是使在阳极产生的氯气和在阴极产生的氢氧化钠,混合在一起反应生成NaClO而影响烧碱的质量;
故答案为:生成的氯气在阳极,生产的氢氧化钠在阴极,可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量
③分析装置图可知,该电解过程中可循环使用的物质是淡盐水,NaOH是产物;
故答案为:淡盐水;
④精制前的食盐水中含有较多的Ca2+、Mg2+、SO42-等杂质离子,需要加入试剂使杂质离子沉淀后,再通过过滤操作除去;
故答案为:过滤.
| ||
故答案为:2NaCl+2H2O
| ||
②使用离子交换膜把电解槽分隔成阴极室和阳极室的目的是使在阳极产生的氯气和在阴极产生的氢氧化钠,混合在一起反应生成NaClO而影响烧碱的质量;
故答案为:生成的氯气在阳极,生产的氢氧化钠在阴极,可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量
③分析装置图可知,该电解过程中可循环使用的物质是淡盐水,NaOH是产物;
故答案为:淡盐水;
④精制前的食盐水中含有较多的Ca2+、Mg2+、SO42-等杂质离子,需要加入试剂使杂质离子沉淀后,再通过过滤操作除去;
故答案为:过滤.
点评:本题考查了电解原理的应用,电极判断和电极反应产物判断是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于乙烯和氯乙烯相同点的下列说法不正确的是( )
| A、都属于有机物中的烃类 |
| B、都含双键而具有不饱和性 |
| C、都可发生加聚反应 |
| D、都是重要的化工生产原料 |
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,反应方程式为Br2+SO2+2H2O=2HBr+H2SO4.下列说法正确的是( )
| A、Br2在反应中被氧化 |
| B、SO2在反应中表现还原性 |
| C、Br2是还原剂 |
| D、1mol氧化剂在反应中失去2mol电子 |
下列有关“三废”污染及其防治的说法,不恰当的是( )
| A、施用农药、化肥会污染土壤,但不至于污染大气和水体 |
| B、加强对废渣等固体废弃物的治理既可减少污染又充分利用了资源 |
| C、空气质量日报的内容是氮氧化物、硫氧化物和可吸入颗粒物这三类主要的污染物 |
| D、含磷洗衣粉随污水排入水体中,导致水体富营养化,是导致水华、赤潮的原因之一 |
下列物质中,属于电解质的是( )
| A、蔗糖 | B、铜 |
| C、硝酸钾 | D、纯碱溶液 |

