题目内容
含有MgCl2、KCl、K2SO4三种盐的2L混合溶液中,若K+为0.8mol,Cl-为1.3mol,Mg2+为0.5mol,则SO42-的物质的量浓度为( )
| A、0.1mol/L |
| B、0.125mol/L |
| C、0.25mol/L |
| D、0.5mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:混合溶液呈电中性,根据电荷守恒有n(Cl-)+2n(SO42-)=n(K+)+2n(Mg2+),据此计算n(SO42-),再根据c=
计算SO42-的物质的量浓度.
| n |
| V |
解答:
解:混合溶液呈电中性,根据电荷守恒有n(Cl-)+2n(SO42-)=n(K+)+2n(Mg2+),故:
1.3mol+2n(SO42-)=0.8mol+0.5mol×2
解得:n(SO42-)=0.25 mol,
SO42-的物质的量浓度=
=0.125mol/L
故选B.
1.3mol+2n(SO42-)=0.8mol+0.5mol×2
解得:n(SO42-)=0.25 mol,
SO42-的物质的量浓度=
| 0.25mol |
| 2L |
故选B.
点评:本题考查物质的量浓度的有关计算,难度中等,注意电解质混合溶液中离子浓度的计算经常利用电荷守恒进行计算.

练习册系列答案
相关题目
下列过程中涉及化学变化,且属于氧化还原反应的是( )
| A、家庭中经常用食醋浸泡有水垢的水壶 |
| B、焰色反应鉴别氯化钠和氯化钾溶液 |
| C、日本福岛核电站核反应堆中U-235裂变产生氙-133和氙-135 |
| D、交通警察用酸性重铬酸钾检查司机是否酒后驾车 |
一定温度下,体积不变的密闭容器中进行下列可逆反应:N2+3H2?2NH3,请判断下列各情况能说明该反应已经达到化学平衡状态的是( )
| A、反应物浓度等于生成物浓度 |
| B、容器中N2、H2、NH3浓度之比为1:3:2 |
| C、3v(N2正)=v(H2正) |
| D、反应混合体系的压强不随时间的变化而变化 |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、吸热反应在一定的条件下也能发生 |
| D、焓变的符号是△H,单位是kJ?mol-1,反应热的单位是kJ |
下列离子方程式书写正确的是( )
A、碳酸钡与盐酸反应:CO
| ||||
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ | ||||
C、硫酸镁溶液与氢氧化钡溶液反应:MgSO4+2OH-═Mg(OH)2↓+SO
| ||||
D、碳酸氢钠溶液中加入烧碱溶液:HCO
|
下列说法正确的是( )
| A、氧的摩尔质量是32g/mol |
| B、Al3+的摩尔质量是27g/mol |
| C、2molCO2的质量是88g/mol |
| D、1molH2S的摩尔质量是34g |
在一定条件下,2体积气体X完全分解生成1体积A2和3体积气体B2,(体积在相同条件下测定),则X的化学式是( )
| A、AB |
| B、AB2 |
| C、AB3 |
| D、A2B3 |
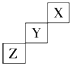 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )| A、Z可能是活泼金属元素 |
| B、X的最高价氧化物对应的水化物是一种强酸 |
| C、Y元素原子的最外层电子数为7 |
| D、Z的最高价氧化物对应水化物的化学式为HZO3 |