题目内容
 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH -) |
| B、b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| C、c点时:c(OH-)=c(CH3COOH)+c(H+) |
| D、d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根离子的水解程度;
B.b点时溶液的pH=7,c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.c点时,恰好反应生成醋酸钠溶液,根据电荷守恒和物料守恒进行判断;
D.d点氢氧化钠过量,为NaOH和CH3COONa的混合物,溶液呈碱性.
B.b点时溶液的pH=7,c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.c点时,恰好反应生成醋酸钠溶液,根据电荷守恒和物料守恒进行判断;
D.d点氢氧化钠过量,为NaOH和CH3COONa的混合物,溶液呈碱性.
解答:
解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),故A错误;
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),则c(Na+)=c(CH3COO-),溶液中离子浓度关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中,根据电荷守恒可得:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带人①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.d点为NaOH和CH3COONa的混合物,氢氧化钠过量,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选A.
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),则c(Na+)=c(CH3COO-),溶液中离子浓度关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中,根据电荷守恒可得:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带人①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.d点为NaOH和CH3COONa的混合物,氢氧化钠过量,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选A.
点评:本题考查酸碱混合的判断和离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解判断溶液中离子浓度大小.

练习册系列答案
相关题目
下列操作,无法实现实验目的是( )
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 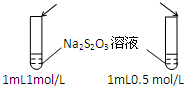 |
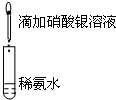 |
| C.目的:温度对化学平衡的影响 | D.目的:探究醋酸、碳酸、苯酚的酸性强弱 |
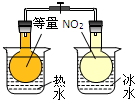 |
 |
| A、A | B、B | C、C | D、D |
下列说法中,正确的是( )
| A、苯、乙醇和乙酸都能发生取代反应 |
| B、CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、使用溴的四氯化碳溶液或酸性KMnO4溶液都可以除去乙烷中混有的乙烯 |
下列四种有机物在核磁共振氢谱图中特征峰个数与(CH3)2CHCH2CH3一样多的是( )
| A、(CH3)2CHCH(CH3)2 |
| B、(CH3CH2)2CHOH |
C、 |
D、 |
在H2SO4、K2SO4、Al2(SO4)3和明矾[KAl(SO4)2?12H2O]的混合溶液中,H+的浓度为0.2mol/L,SO42-的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
| A、0.225mol/L |
| B、0.25mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
(普通班做)下列各项不属于官能团的是( )
| A、-NO2 |
| B、NO2 |
| C、_OH |
| D、-Cl |
下列除去杂质的方法正确的是( )
| 需提纯的物质 | 所含杂质 | 除杂方法 | |
| A | 乙烷 | 乙烯 | 通过酸性高锰酸钾溶液、洗气 |
| B | 乙醇 | 水 | 蒸馏 |
| C | 乙酸乙酯 | 乙酸 | 加入NaOH溶液,充分振荡、分液 |
| D | 乙醇 | 乙酸 | 加入足量的CaO、蒸馏 |
| A、A | B、B | C、C | D、D |
下列在水溶液中的电离方程式中,正确的是( )
| A、CH3COOH═CH3COO-+H+ |
| B、Ba(OH)2═Ba2++2OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、NaHCO3═Na++H++CO32- |
下列装置或操作能达到实验目的是( )
A、 分离乙醇和水 |
B、 除去氯气中的氯化氢 |
C、 葡萄糖的银镜反应 |
D、 石油的蒸馏 |