题目内容
25℃在等体积的①pH=0的H2SO4溶液,②0.05mol?L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1:10:1010:109 | B.1:5:5×109:5×109 |
| C.1:20:1010:109 | D.1:10:104:109 |
设溶液的体积为1L,
①中pH=0的H2SO4中c(H+)=1.0 mol?L-1,c(OH-)=1.0×10-14mol?L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol?L-1,c(H+)=1.0×10-13mol?L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol?L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol?L-1,水的电离的物质的量为1.0×10-5mol.
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,A项正确.
故选A.
①中pH=0的H2SO4中c(H+)=1.0 mol?L-1,c(OH-)=1.0×10-14mol?L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol?L-1,c(H+)=1.0×10-13mol?L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol?L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol?L-1,水的电离的物质的量为1.0×10-5mol.
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,A项正确.
故选A.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(14分)(1)二氧化硫的催化氧化的过程如图所示,
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。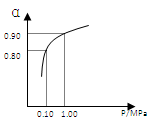
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
 (2013?淄博二模)(1)在固定容积为2L的密闭容器中通入NO和CO各2mol发生反应:
(2013?淄博二模)(1)在固定容积为2L的密闭容器中通入NO和CO各2mol发生反应: 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.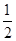 O2(g)=CO2(g)
△H2=b kJ·mol-1
O2(g)=CO2(g)
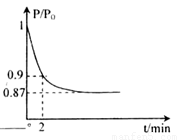
△H2=b kJ·mol-1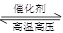 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中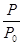 与时间t的关系如图所示。
与时间t的关系如图所示。