题目内容
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+
| 1 |
| 2 |
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
(2)某实验小组模拟工业合成氨反应N2+3H2
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |
分析:Ⅰ、依据热化学方程式和盖斯定律计算,根据燃烧热概念计算得到;
Ⅱ、(1)电池的构成原理是自发进行的氧化还原化学反应在理论上可以设计成原电池;以熔融的K2CO3与CO2为反应的环境,负极是失电子发生氧化反应的电极;
(2)①依据平衡标志是正逆反应速率相同,各组分保持不变,分析选项判断;
②分析图象结合压强之比等于气体物质的量之比,反应前后气体体积减少为生成氨气的量,计算氮气的反应速率;
③提高转化率,使平衡正向进行;
(3)依据沉淀转化关系结合溶度积常数计算得到;
Ⅱ、(1)电池的构成原理是自发进行的氧化还原化学反应在理论上可以设计成原电池;以熔融的K2CO3与CO2为反应的环境,负极是失电子发生氧化反应的电极;
(2)①依据平衡标志是正逆反应速率相同,各组分保持不变,分析选项判断;
②分析图象结合压强之比等于气体物质的量之比,反应前后气体体积减少为生成氨气的量,计算氮气的反应速率;
③提高转化率,使平衡正向进行;
(3)依据沉淀转化关系结合溶度积常数计算得到;
解答:解:I.①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
②CO(g)+
O(g)=CO2(g)△H=bKJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
依据盖斯定律①×2+②×6+③,6C(s)+6O2(g)=6CO2(g)△H=(2a+6b+c)kJ?mol-1
碳的燃烧热C(s)+O2(g)=CO2(g)△H=
kJ?mol-1
故答案为:
;
Ⅱ.(1)电池的构成原理是自发进行的氧化还原化学反应在理论上可以设计成原电池
A.C(s)+C02(g)=2C0(g),是吸热反应,不能涉及成原电池,故A不符合;
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1),是复分解反应,不是氧化还原反应,故B不符合;
C.2H20(l)=2H2(g)+02(g),反应是非自发进行的氧化还原反应,故C不符合;
D.2C0(g)+02(g)=2C02(g),反应是自发进行的氧化还原反应,故D符合;
一氧化碳燃料电池在熔融的K2CO3与CO2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e-+CO32-=2CO2 ;
故答案为:D,CO-2e-+CO32-=2CO2 ;
(2)①氮气和氢气合成氨气的反应是气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
A.反应是气体体积变化的反应,压强保持不变说明反应达到平衡,故A正确;
B.反应过程中气体质量不变,体积不变,反应过程中密度不变,气体密度保持不变,不能说明反应达到平衡,故B错误;
C.NH3的生成速率是N2的生成速率的2倍,说明正逆反应反应速率相同,反应达到平衡,故C正确;
故答案为:AC;
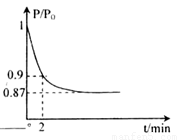
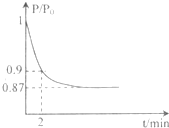
②2min时压强之比为P;Po=0.9,相同条件下气体物质的量之比等于压强之比,设反应后的气体物质的量为n,则P:Po=n:20=0.9,n=18mol,反应前后物质的量减小2mol,依据反应的过程分析,减少的物质的量为生成的氨气物质的量,氨气表示的反应速率=
=0.2mol/L?min,依据反应速率之比等于化学方程式系数之比得到氮气表示的反应速率为0.11mol?L-1?min-1;
故答案为:0.1mol?L-1?min-1;
③提高N2的转化率可采取的措施是平衡正向进行
A.向体系中按体积比1:1再充入N2和H2,恒温恒容容器中计入铜比例的起始量相当于增大压强,平衡正向进行,氮气的转化率增大,故A符合;
B.分离出NH3,平衡正向进行,氮气的转化率增大,故B符合;
C.反应是吸热反应,升高温度平衡逆向进行,氮气的转化率减小,故C不符合;
D.充入He气使压强增大,恒温恒容容器中 气体分压不变,平衡不动,故D不符合;
E.加入一定量的N2,提高氢气的转化率,打不起的转化率减小,故E不符合;
故答案为:AB;
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
)=0.2mol?L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,分析沉淀转化关系BaCO3+SO42-=BaSO4+CO32-,反应的平衡常数=
=
=
,c(SO42-)=
=2.5×10-3mol/L,加入Na2SO4溶液的物质的量浓度最小是2.5×10-3mol/L;
故答案为:2.5×10-3;
②CO(g)+
| 1 |
| 2 |
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
依据盖斯定律①×2+②×6+③,6C(s)+6O2(g)=6CO2(g)△H=(2a+6b+c)kJ?mol-1
碳的燃烧热C(s)+O2(g)=CO2(g)△H=
| 2a+6b+c |
| 6 |
故答案为:
| 2a+c+6b |
| 6 |
Ⅱ.(1)电池的构成原理是自发进行的氧化还原化学反应在理论上可以设计成原电池
A.C(s)+C02(g)=2C0(g),是吸热反应,不能涉及成原电池,故A不符合;
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1),是复分解反应,不是氧化还原反应,故B不符合;
C.2H20(l)=2H2(g)+02(g),反应是非自发进行的氧化还原反应,故C不符合;
D.2C0(g)+02(g)=2C02(g),反应是自发进行的氧化还原反应,故D符合;
一氧化碳燃料电池在熔融的K2CO3与CO2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e-+CO32-=2CO2 ;
故答案为:D,CO-2e-+CO32-=2CO2 ;
(2)①氮气和氢气合成氨气的反应是气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
A.反应是气体体积变化的反应,压强保持不变说明反应达到平衡,故A正确;
B.反应过程中气体质量不变,体积不变,反应过程中密度不变,气体密度保持不变,不能说明反应达到平衡,故B错误;
C.NH3的生成速率是N2的生成速率的2倍,说明正逆反应反应速率相同,反应达到平衡,故C正确;
故答案为:AC;
②2min时压强之比为P;Po=0.9,相同条件下气体物质的量之比等于压强之比,设反应后的气体物质的量为n,则P:Po=n:20=0.9,n=18mol,反应前后物质的量减小2mol,依据反应的过程分析,减少的物质的量为生成的氨气物质的量,氨气表示的反应速率=
| ||
| 2min |
故答案为:0.1mol?L-1?min-1;
③提高N2的转化率可采取的措施是平衡正向进行
A.向体系中按体积比1:1再充入N2和H2,恒温恒容容器中计入铜比例的起始量相当于增大压强,平衡正向进行,氮气的转化率增大,故A符合;
B.分离出NH3,平衡正向进行,氮气的转化率增大,故B符合;
C.反应是吸热反应,升高温度平衡逆向进行,氮气的转化率减小,故C不符合;
D.充入He气使压强增大,恒温恒容容器中 气体分压不变,平衡不动,故D不符合;
E.加入一定量的N2,提高氢气的转化率,打不起的转化率减小,故E不符合;
故答案为:AB;
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |
| c(CO32-) |
| c(SO42-) |
| Ksp(BaCO3) |
| Ksp(SO42-) |
| 8×10-9 |
| 1×10-10 |
| 0.2mol/L×1×10-10 |
| 8×10-9 |
故答案为:2.5×10-3;
点评:本题考查了热化学方程式和盖斯定律计算应用,原电池反应和原理,电极反应书写方法,平衡标志,平衡影响因素分析判断,沉淀溶解平衡和溶度积常数的计算,题目难度中等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目

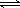 2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
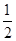 O2(g)=CO2(g)
△H2=b kJ·mol-1
O2(g)=CO2(g)
△H2=b kJ·mol-1 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中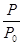 与时间t的关系如图所示。
与时间t的关系如图所示。