题目内容
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)= 2Fe(s)+3CO(g) △H1=a kJ·mol-1
CO(g)+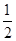 O2(g)=CO2(g)
△H2=b kJ·mol-1
O2(g)=CO2(g)
△H2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=c kJ·mol-1
则C的燃烧热________kJ·mol-1
II.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是____(填序号)。
A.C(s)+CO2(g)=2CO(g) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l) = 2H2(g)+O2(g) D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:___________。
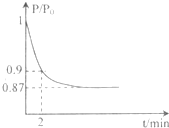
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g)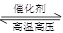 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
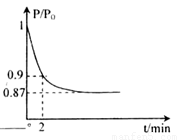
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中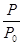 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以c(N2)变化表示的平均反应速率为________。
③若提高N2的转化率可采取的措施有________。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2mol·L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol • L-1。
I.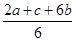
Ⅱ.(1)D CO-2e- + CO32-=2CO2
(2)①AC ② 0.1mol·L-1·min-1 ③AB
(3)2.5×10-3
【解析】
试题解析:I.燃烧热指1mol可燃物完全燃烧生成稳定化合物时放出的热量。依据盖斯定律,将第一个方程式乘以2,加上第二个方程式乘以6,加上第三个方程式,得到的方程式再除以6,可得到目标方程式C(s)+O2(g)=CO2(g),焓变作相应变化即可。
II.(1)原电池反应需要是自发进行的氧化还原反应,据此可知只有D反应符合要求。
依据CO燃烧设计的原电池属于燃料电池,负极燃料失电子;因电解质是熔融的K2CO3,故负极反应式为CO与CO32-结合失电子生成CO2。
(2)①该反应是一个气体分子总数发生变化的反应,因此压强不变可说明反应达到平衡状态,A正确;容器容积不变,气体总质量不变,故气体密度一直不变,B错;氨气的生成速率是正反应速率,氮气的生成速率是逆反应速率,二者的速率比为2:1时,说明正逆反应速率相等,反应达到平衡,C正确。
②设反应消耗的氮气的物质的量为amol,则有
N2 +3H2
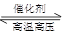 2NH3
2NH3
初始量/mol:10 10 0
变化量/mol:a 3a 2a
最终量/mol:10-a 10-3a 2a
根据图像,2min时P/P0=0.9,根据相同条件下气体压强比等于物质的量之比,则有
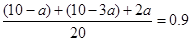 ,解得a=1,
,解得a=1,
则以氮气表示的反应速率为: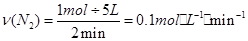 。
。
③欲提高氮气的转化率,需使平衡正向移动,但不能通过增加氮气的量实现。向体系中按1:1增加氮气和氢气,与原比例相同,相当于增大压强,平衡正向移动,氮气转化率提高,A正确;分离出氨气,则平衡正向移动,B正确;反应放热,升高温度平衡逆向移动,C错;因容器容积不变,充入惰性气体对平衡无影响,D错;加入氮气,平衡虽然正向移动,但氮气的转化率会减小,E错。
(3)含有BaCO3沉淀的悬浊液已达到沉淀溶解平衡,再加入Na2SO4使沉淀转化为BaSO4,此时溶液中的c(Ba2+)相同,故有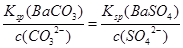 ,则
,则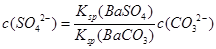 ,代入数据,可得
,代入数据,可得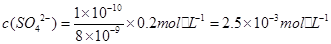 。
。
考点:考查盖斯定律应用,原电池电极反应式书写,化学反应速率计算,化学平衡状态判断及影响因素,图像分析,沉淀溶解平衡计算等。

 阅读快车系列答案
阅读快车系列答案
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关. 2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题: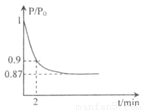
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1