题目内容
下列叙述正确的是( )
| A、电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 |
| C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1molNaOH |
| D、酸、碱、盐溶液电解后pH都增大 |
考点:电解原理
专题:电化学专题
分析:A、解池的阴极上是发生得电子的还原反应;
B、用惰性电极电解Na2SO4溶液,实质是电解水;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算分析;
D.根据电解池的工作原理结合电解实质来回答.
B、用惰性电极电解Na2SO4溶液,实质是电解水;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算分析;
D.根据电解池的工作原理结合电解实质来回答.
解答:
解:A、原电池中,负极失电子发生氧化反应,电解池中阴极得到电子发生还原反应,故A错误;
B、惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故B错误;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e-=H2↑,若有1mol电子转移,氢离子减小1mol,溶液中氢氧根离子增加1mol,则生成1mol NaOH,故C正确;
D、硫酸电解后pH减小,硫酸铜电解后溶液pH减小,故D错误.
故选C.
B、惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故B错误;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e-=H2↑,若有1mol电子转移,氢离子减小1mol,溶液中氢氧根离子增加1mol,则生成1mol NaOH,故C正确;
D、硫酸电解后pH减小,硫酸铜电解后溶液pH减小,故D错误.
故选C.
点评:本题考查学生原电池和电解池的工作原理以及应用知识,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑他们间的相互反应)的试剂组是( )
| A、盐酸、硫酸 |
| B、盐酸、NaOH溶液 |
| C、氨水、硫酸 |
| D、氨水、NaOH溶液 |
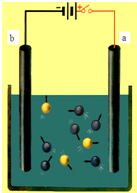 如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )
如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )| A、a为正极,b为负极 |
| B、a极上发生还原反应 |
| C、电解过程中,b电极上有铜析出 |
| D、电解过程中,氯离子浓度保持不变 |
用惰性电极电解100mL含0.02molCuSO4溶液,当有0.08NA个e-通过时,停止电解,要使电解质溶夜恢复到原来的浓度,需向电解后的溶液中加入的物质是( )
| A、CuO |
| B、CuCO3 |
| C、Cu(OH)2 |
| D、Cu2(OH)2CO3 |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A、NaOH、H2SO4、Na2SO4 |
| B、NaOH、AgNO3、H2SO4 |
| C、HCl、CuBr2、Ba(OH)2 |
| D、KBr、H2SO4、Ba(OH)2 |
 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.