题目内容
下列有关铁及其化合物的离子方程式一定错误的是( )
| A、氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O |
| B、铁与足量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、磁性氧化铁与浓盐酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、溴化亚铁溶液与氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.发生氧化还原反应,生成碘化亚铁和碘、水;
B.反应生成硝酸铁、NO和水;
C.反应生成氯化亚铁、氯化铁、水;
D.氯水足量时,亚铁离子、溴离子均全部被氧化,生成氯化铁、溴.
B.反应生成硝酸铁、NO和水;
C.反应生成氯化亚铁、氯化铁、水;
D.氯水足量时,亚铁离子、溴离子均全部被氧化,生成氯化铁、溴.
解答:
解:A.氢氧化铁与氢碘酸反应的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++6H2O+I2,故A错误;
B.铁与足量稀硝酸反应的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故B正确;
C.磁性氧化铁与浓盐酸反应的离子反应为Fe3O4+8H+═Fe2++2Fe3++4H2O,故C正确;
D.溴化亚铁溶液与氯水反应的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故D正确;
故选A.
B.铁与足量稀硝酸反应的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故B正确;
C.磁性氧化铁与浓盐酸反应的离子反应为Fe3O4+8H+═Fe2++2Fe3++4H2O,故C正确;
D.溴化亚铁溶液与氯水反应的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故D正确;
故选A.
点评:本题考查离子反应的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,注意与量有关的离子反应及氧化还原反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于各装置图的叙述中,不正确的是( )
A、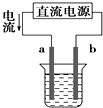 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
若a、b、c、d均大于零,下列能正确表示燃烧热的热化学方程式为( )
| A、CH3CH2OH(l)+3O2 (g)=2CO2 (g)+3H2O(l)△H=-a kJ/mol | ||
| B、CH4 (g)+2O2 (g)=2H2O(g)+CO2(g)△H=-b kJ/mol | ||
C、H2 (g)+
| ||
| D、2CH≡CH(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-d kJ/mol |
短周期元素X、Y、Z、W、R的原子序数依次增大,元素的最高正价与最低负价如下:
下列说法不正确的是( )
| X | Y | Z | W | R |
| +4-4 | -2 | +1 | +3 | +7-1 |
| A、原子半径:Z>X>Y |
| B、R的含氧酸的酸性一定强于X的含氧酸的酸性 |
| C、X和Y可形成多种共价化合物 |
| D、工业上用电解W的氧化物的方法制备单质W |
下列装置中能构成原电池的是( )
A、 硫酸铜溶液 |
B、 硫酸铜溶液 |
C、 稀硫酸 |
D、 乙醇 |
下列有关热化学方程式书写及对应表述均正确的是( )
| A、密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 |
| B、稀醋酸与0.1mol?L-1NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=57.3kJ?mol-1 |
| C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1 |
| D、已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1 |
工业生产硫酸时,其中一步反应是2SO2+O2?2SO3,该反应正反应是放热反应,下列说法不正确的是( )
| A、升高温度可提高反应速率 |
| B、使用催化剂能增大反应速率 |
| C、增大氧气浓度可提高SO2的转化率 |
| D、达到化学平衡时正逆反应速率相等且都为零 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.