题目内容
11.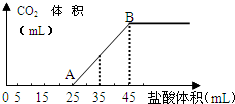 将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:(1)写出OA段所发生反应的离子方程式H++OH-=H2O、CO32-+H+=HCO3-.
(2)当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
(3)原混合物中NaOH的质量为0.2g,碳酸钠的物质的量为0.02mol.
分析 (1)OA段发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaHCO3+NaCl;
(2)生成二氧化碳发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗HCl体积为HCl(35-25)mL=10mL,结合方程式计算;
(3)25mL-45mL段生成二氧化碳,根据消耗HCl计算NaHCO3的物质的量,根据碳原子守恒计算Na2CO3的物质的量,消耗盐酸45mL时溶液中溶质为NaCl,根据氯离子守恒计算NaCl物质的量,再根据钠离子守恒计算NaOH物质的量,进而计算NaOH质量.
解答 解:(1)OA段发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaHCO3+NaCl,离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:H++OH-=H2O、CO32-+H+=HCO3-;
(2)生成二氧化碳发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗HCl体积为HCl(35-25)mL=10mL,则n(CO2)=n(HCl)=0.01L×1mol/L=0.01mol,故生成CO2的体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224;
(3)25mL-45mL段生成二氧化碳,该阶段消耗盐酸体积为20mL,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知n(NaHCO3)=n(HCl)=0.02L×1mol/L=0.02mol,根据碳原子守恒n(Na2CO3)=n(NaHCO3)=0.02mol,消耗盐酸45mL时溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n(HCl)=0.045L×1mol/L=0.045mol,根据钠离子守恒,可知NaOH物质的量为0.045mol-0.02mol×2=0.005mol,故NaOH质量为0.005mol×40g/mol=0.2g,
故答案为:0.2;0.02mol.
点评 本题考查混合物有关计算,根据图象判断各阶段发生的反应是解题关键,注意守恒法的运用用,题目难度中等.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 2Na+2H2O?2NaOH+H2↑ | B. | Cl2+H2O?HCl+HClO | ||
| C. | NH3•H2O?NH3+H2O | D. | N2+3H2$?_{高温高压}^{催化剂}$2NH3 |
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).Ⅰ.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂.
(3)读取盛装0.100 0mol/L NaOH溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.滴定终点的现象是溶液由无色恰好变为浅红色,并在半分钟内不褪色.
Ⅱ.数据记录:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL=15.24mL.
(5)指出他的计算的不合理之处:第一组数据与后三组数据相差较大,属于异常值,应舍去;按正确数据处理,可得市售白醋总酸量=4.500g/100mL.(结果保留四位有效数字)
| A. | 10、16、32 | B. | 8、18、28 | C. | 16、26、36 | D. | 34、44、54 |
| A. | Si | B. | Mg | C. | MgO | D. | Al2O3 |
| A. | 1:2:1 | B. | 2:1:2 | C. | 4:22:7 | D. | 8:11:14 |
| A. | 水 | B. | 石蕊试液 | C. | 氢氧化钠溶液 | D. | 溴水 |
 人们对苯及芳香烃的认识有一个不断深化的过程.
人们对苯及芳香烃的认识有一个不断深化的过程. :该结构的一氯代物有1种.
:该结构的一氯代物有1种. ,下列关于萘的说法正确的是CD(填编号)
,下列关于萘的说法正确的是CD(填编号)